探索Ciltacabtagene autoleucel (cilta-cel)治疗多发性骨髓瘤的突破性进展!CARTITUDE-1试验显示,部分患者实现5年无进展生存,甚至有望治愈且无需维持治疗。了解这款CAR-T疗法如何为复发/难治性多发性骨髓瘤患者带来希望,以及海外购药途径。 Read More... "西达基奥仑赛(cilta-cel)治疗多发性骨髓瘤:5年无进展生存,有望实现“临床治愈”"
聚焦全球抗癌药物信息,为癌症患者提供详尽的靶向药物和免疫药物资讯。内容涵盖药物研发进程、最新研究成果、技术创新、临床试验数据,以及药物的临床试验设计、参与条件、疗效评估和安全性监测等信息。同时,将及时更新药物上市审批动态,包括各国药品监管机构的审核标准和政策变化,以帮助相关人员理解抗癌药物的市场动态。通过整合与分享信息,期望促进抗癌领域的研究与合作,为患者提供更多治疗选择与希望。
FDA批准司美替尼(Selumetinib)用于治疗1岁及以上儿童神经纤维瘤病1型(NF1)相关、有症状且不可手术的丛状神经纤维瘤。了解这款靶向药的最新进展、儿童用药信息及海外购药途径,为患儿带来新希望。 Read More... "司美替尼(Selumetinib)获FDA批准:儿童神经纤维瘤病1型(NF1)治疗新希望"
探索塔拉妥单抗联合PD-L1抑制剂治疗广泛期小细胞肺癌的最新临床进展。DeLLphi 303试验数据显示,该方案在OS和PFS方面表现出持久疗效与良好安全性。了解塔拉他单抗如何为小细胞肺癌患者带来新希望,以及海外购药途径。 Read More... "广泛期小细胞肺癌新突破:塔拉妥单抗联合PD-L1抑制剂展现持久疗效与安全性"
FDA授予瑞鲁度他德鲁替康(R-DXd)突破性疗法认定,为铂耐药卵巢癌、腹膜癌及输卵管癌患者带来新希望。这款靶向CDH6的创新药物,尤其适用于经贝伐珠单抗治疗后的患者,其临床试验展现出显著疗效。了解R-DXd的最新进展与购药途径,为您的抗癌之路寻找更多可能。 Read More... "瑞鲁度他德鲁替康(R-DXd)获FDA突破性疗法认定:铂耐药卵巢癌、腹膜癌及输卵管癌治疗新突破"
Ziftomenib在NPM1突变复发/难治性急性髓系白血病(AML)患者中展现显著疗效,KOMET-001临床试验结果积极。了解这款新型menin抑制剂的安全性、生存期数据及未来FDA批准前景。海外靶向药代购,助您获取最新治疗方案。 Read More... "Ziftomenib单药治疗NPM1突变复发/难治性AML:KOMET-001临床试验揭示突破性疗效"
深入了解大B细胞淋巴瘤二线治疗新标准:阿基仑赛 (Yescarta) 与 利基迈仑赛(Breyanzi) CAR T细胞疗法。探索其疗效、安全性及临床数据,助您了解海外购药渠道,获取最新治疗方案。立即咨询,为癌症患者寻找希望! Read More... "大B细胞淋巴瘤二线治疗新突破:阿基仑赛与利基迈仑赛CAR T细胞疗法深度解析"
新型核酸适配体偶联药物(ApDC)Sgc8c-M在临床前研究中展现出强大的抗癌潜力。该药靶向PTK7,能有效抑制多种癌症模型,且安全性良好。了解Sgc8c-M的最新研究进展和未来应用前景。 Read More... "Sgc8c-M:靶向PTK7的新型ApDC药物,为癌症治疗带来新希望"
欧盟批准MMR IHC Panel pharmDx诊断工具,助力识别dMMR结直肠癌患者,使其能接受纳武利尤单抗与伊匹木单抗联合免疫治疗。了解海外购药途径与最新治疗方案,为癌症患者提供希望。 Read More... "dMMR结直肠癌治疗新突破:欧盟批准诊断工具,助力纳武利尤单抗与伊匹木单抗精准用药"
帕博利珠单抗(Keytruda)联合化疗在可切除非小细胞肺癌患者中展现显著疗效,无论淋巴结状态如何,均能改善生存期。了解最新临床数据、治疗方案及海外购药途径,为肺癌患者带来新希望。立即咨询,获取帕博利珠单抗购买信息。 Read More... "帕博利珠单抗(Keytruda)显著改善非小细胞肺癌患者生存期:最新临床数据解读"
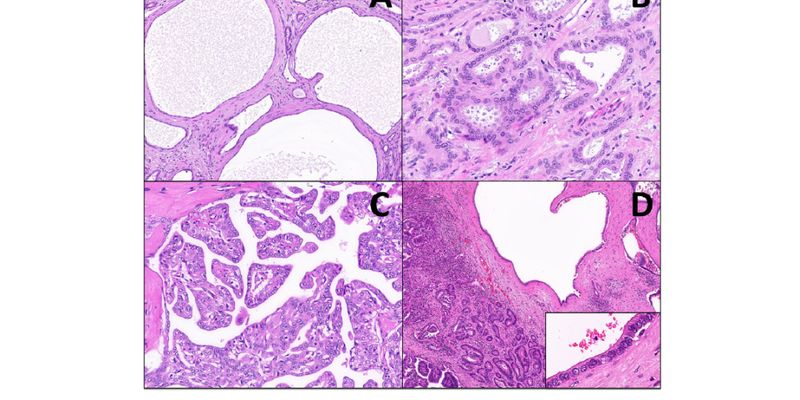
警惕胆管腺纤维瘤(BAF)的恶性转化风险!研究揭示BAF与肝内胆管癌密切相关,并常伴有IDH2、FGFR2等可靶向基因突变。了解BAF的分子特征,为胆管癌患者精准治疗提供关键信息,探索海外靶向药购药途径。 Read More... "警惕胆管腺纤维瘤恶性风险:揭示与肝内胆管癌关联及IDH2、FGFR2等靶向基因变异"
耶鲁大学研究揭示急性巨核细胞白血病(AMKL)新治疗靶点,发现RBM15-MKL1融合蛋白与m6A修饰、Wnt信号通路的关键机制。这项突破性发现为AMKL及其他急性髓系白血病(AML)患者带来创新疗法希望,未来或有靶向药问世。了解最新癌症治疗进展,探索海外购药途径。 Read More... "急性髓系白血病(AML)新突破:耶鲁大学揭示AMKL潜在靶向治疗新路径"
FDA批准吉西他滨膀胱内灌注系统Inlexzo,为BCG耐药非肌层浸润性膀胱癌患者带来新希望。了解这款新药的显著疗效、副作用及海外购药途径,助您获取前沿治疗方案。 Read More... "BCG耐药非肌层浸润性膀胱癌新突破:吉西他滨膀胱内灌注系统获FDA批准"
深入了解非小细胞肺癌EGFR-TKI靶向药的心脏风险。BMJ研究揭示,奥希替尼等一代/三代EGFR-TKI均增加心血管不良事件。关注用药安全,了解副作用,为您的抗癌之路提供重要参考。需要海外靶向药代购?立即咨询。 Read More... "非小细胞肺癌EGFR-TKI靶向药:奥希替尼等药物的心脏风险与用药安全警示"
探索非小细胞肺癌(NSCLC)治疗新进展!了解度伐利尤单抗在III期NSCLC中的应用,以及阿美替尼联合化疗对EGFR突变肺癌的疗效。获取海外靶向药代购信息,助您寻找前沿治疗方案。 Read More... "非小细胞肺癌治疗新突破:度伐利尤单抗与阿美替尼临床研究进展"
FDA已受理Relacorilant新药申请,为铂耐药卵巢癌患者带来新希望。这款靶向药联合纳米炭紫杉醇,在临床试验中显著改善患者生存期。了解Relacorilant疗效、副作用及海外购药途径,助您抗癌。 Read More... "Relacorilant新药申请获FDA受理:铂耐药卵巢癌治疗迎来新突破"
FDA已批准新药伊美雌兰(imlunestrant)用于治疗经内分泌治疗后进展的ER+/HER2-、ESR1突变晚期乳腺癌。了解该药如何显著延长无进展生存期,以及详细的副作用和用药信息。 Read More... "伊美雌兰获FDA批准:为ESR1突变晚期乳腺癌患者带来治疗新希望"
广泛期小细胞肺癌(ES-SCLC)治疗迎来重大突破!ETER701研究证实,贝莫苏拜单抗联合安罗替尼及化疗的四药方案,将患者中位总生存期显著延长至19.3个月,为寻求更有效一线治疗方案的患者带来新希望。 Read More... "生存期近20个月!贝莫苏拜单抗联合安罗替尼改写广泛期小细胞肺癌一线治疗格局"
曲妥珠单抗德鲁替康(Enhertu)获EMA验证,FDA已加速批准用于HER2阳性不可切除或转移性实体瘤。了解这款靶向药在结直肠癌、非小细胞肺癌等多种癌症中的显著疗效,以及海外购药途径。 Read More... "HER2阳性实体瘤治疗新突破:曲妥珠单抗德鲁替康(Enhertu)泛瘤种适应症获EMA验证与FDA批准"
FDA近期批准多款新药,包括用于HER2突变非小细胞肺癌的zongertinib和EGFR突变肺癌的sunvozertinib。本文详细介绍这些新疗法的疗效、副作用及推荐剂量。 Read More... "FDA新药盘点:Zongertinib与Sunvozertinib获批治疗非小细胞肺癌,覆盖脑癌、多发性骨髓瘤新疗法"
探索Repotrectinib (Augtyro) 在ROS1阳性非小细胞肺癌中的卓越疗效与颅内活性。了解这款靶向药如何显著改善TKI初治及经治患者的生存期,并获取Repotrectinib的最新临床数据和购药信息。 Read More... "Repotrectinib (瑞泊替尼) 在ROS1阳性非小细胞肺癌中展现持久疗效与颅内活性"