美国FDA批准简化利基迈伦塞 (Breyanzi) 和艾基维仑赛 (Abecma) 这两种CAR T细胞疗法在治疗大B细胞淋巴瘤、多发性骨髓瘤等B细胞恶性肿瘤时的患者监测要求,并取消风险评估与缓解策略(REMS)项目,旨在提升患者可及性与治疗便利性。了解这些靶向药的最新进展和副作用管理。 Read More... "靶向药新进展:FDA放宽利基迈伦塞与艾基维仑赛监测限制,造福淋巴瘤、骨髓瘤患者"
聚焦全球抗癌药物信息,为癌症患者提供详尽的靶向药物和免疫药物资讯。内容涵盖药物研发进程、最新研究成果、技术创新、临床试验数据,以及药物的临床试验设计、参与条件、疗效评估和安全性监测等信息。同时,将及时更新药物上市审批动态,包括各国药品监管机构的审核标准和政策变化,以帮助相关人员理解抗癌药物的市场动态。通过整合与分享信息,期望促进抗癌领域的研究与合作,为患者提供更多治疗选择与希望。
了解奎扎替尼(Vanflyta)联合化疗在FLT3-ITD阳性急性髓系白血病(AML)患者中的显著疗效。最新研究显示,该方案显著延长患者总生存期,尤其对NPM1等基因突变患者效果更佳。探索奎扎替尼的治疗优势与海外购药途径。 Read More... "奎扎替尼(Vanflyta)联合化疗:FLT3-ITD阳性急性髓系白血病患者的生存新希望"
美国FDA批准镓 Ga-68 戈泽肽注射液(Illuccix)扩展适应症,用于转移性去势抵抗性前列腺癌(mCRPC)患者在紫杉烷前线治疗中进行PET成像,以精准筛选适合放射配体疗法的患者。了解Illuccix的最新进展、适应症、副作用及海外购药途径,助力前列腺癌患者获得更早、更精准的靶向治疗。 Read More... "镓 Ga-68 戈泽肽注射液(Illuccix)FDA扩展批准:mCRPC患者精准筛选靶向治疗新利器"
深入了解弥漫性大B细胞淋巴瘤(DLBCL)的最新治疗策略,包括CAR T细胞疗法、双特异性抗体及BTK降解剂。探索这些创新疗法如何优化患者预后,以及在海外购药时需注意的关键信息,助您找到最适合的靶向药。 Read More... "弥漫性大B细胞淋巴瘤(DLBCL)治疗新选择:CAR T细胞与双特异性抗体深度解析"
伊马替尼口服液(Imkeldi)获批上市,为费城染色体阳性慢性髓性白血病、急性淋巴细胞白血病等癌症的儿童及吞咽困难患者带来福音。了解这款靶向药如何解决口服给药难题,提升治疗依从性与生活质量。MedFind提供海外靶向药代购服务,助您轻松获取所需药品。 Read More... "伊马替尼口服液(Imkeldi)获批:儿童及吞咽困难癌症患者的用药新选择"
了解靶向药泽布替尼(百悦泽)片剂新剂型获批详情,包括其在瓦尔登斯特伦巨球蛋白血症、慢性淋巴细胞白血病等B细胞恶性肿瘤的适应症、用法用量及常见副作用。探索更便捷的用药选择,为癌症患者提供最新药物信息与代购指南。 Read More... "泽布替尼片剂:瓦尔登斯特伦巨球蛋白血症、慢性淋巴细胞白血病等B细胞恶性肿瘤治疗新进展"
深入了解惰性淋巴瘤、弥漫大B细胞淋巴瘤和慢性淋巴细胞白血病等B细胞恶性肿瘤的最新治疗进展。本文探讨伊布替尼、泽布替尼、维奈克拉等BTK抑制剂及CAR T细胞疗法如何革新传统化疗,为患者带来更精准、副作用更小的治疗选择,并提供海外购药信息。 Read More... "B细胞淋巴瘤与白血病治疗新突破:靶向药与CAR T疗法革新传统化疗"
斯鲁利单抗(Serplulimab)作为首个获英国MHRA批准用于广泛期小细胞肺癌(ES-SCLC)一线治疗的PD-1抑制剂,在ASTRUM-005临床试验中显著改善患者总生存期。了解斯鲁利单抗的疗效、安全性及海外购药途径,为小细胞肺癌患者提供新的治疗希望。 Read More... "斯鲁利单抗(Serplulimab)广泛期小细胞肺癌一线治疗新突破:疗效、安全性与海外购药途径解析"
2025年第三季度,FDA将迎来多款创新抗癌新药的审批结果,涵盖非小细胞肺癌、多发性骨髓瘤、淋巴瘤、黑色素瘤等多种癌症类型。本文详细解读舒沃替尼、林沃赛妥单抗、帕博利珠单抗等10款备受关注的靶向药和免疫疗法,探讨其在EGFR Exon 20、HER2突变等靶点上的突破性进展,为癌症患者提供最新的治疗选择和海外购药参考。 Read More... "2025年第三季度:FDA十大抗癌新药审批展望,靶向药与免疫疗法新突破"
深入了解肿瘤免疫治疗与抗体偶联药物(ADC)可能引发的肝损伤风险。本文详细解析免疫检查点抑制剂和靶向药ADC导致肝损伤的机制、高危因素及科学管理策略,助您有效应对治疗副作用,保障抗癌之路顺利进行,为海外购药提供参考。 Read More... "肿瘤免疫治疗与靶向药ADC:如何应对肝损伤副作用?"
帕博利珠单抗(可瑞达)在透明细胞肾细胞癌辅助治疗中展现卓越疗效。KEYNOTE-564研究5年随访数据显示,该药显著改善患者无病生存期和总生存期,巩固其作为高复发风险肾癌标准疗法的地位。了解帕博利珠单抗副作用、用法及海外代购信息,助您获取所需靶向药。 Read More... "帕博利珠单抗巩固透明细胞肾细胞癌辅助治疗标准地位:KEYNOTE-564研究5年随访揭示卓越疗效"
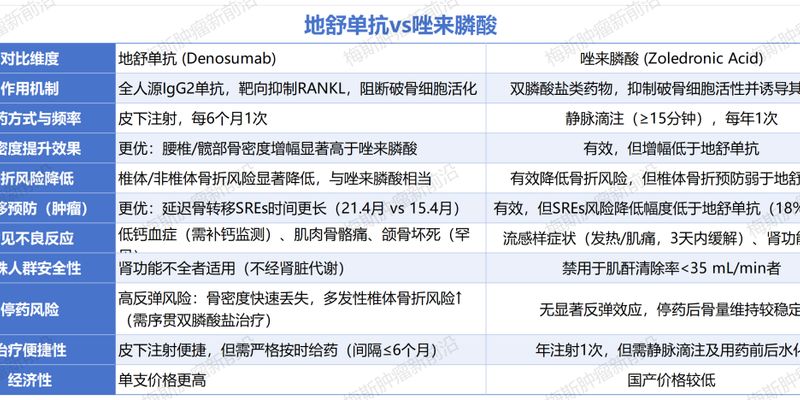
地舒单抗与唑来膦酸是骨质疏松及癌症骨转移治疗的常用药物。本文深入比较地舒单抗和唑来膦酸在疗效、安全性、副作用及适用人群上的差异,助您选择最适合的治疗方案。了解海外靶向药代购、价格及哪里购买等信息,请咨询MedFind。 Read More... "地舒单抗与唑来膦酸哪个好?骨质疏松及骨转移用药深度解析"
欧洲药品管理局CHMP推荐伊沙妥昔单抗(Sarclisa)联合VRd方案用于新诊断、符合移植条件的多发性骨髓瘤患者。了解伊沙妥昔单抗在GMMG-HD7临床试验中的显著疗效,包括提高完全缓解率和MRD阴性率。获取最新多发性骨髓瘤治疗方案信息,探索海外靶向药代购途径。 Read More... "艾莎妥昔单抗(Sarclisa)联合VRd方案:新诊断多发性骨髓瘤患者的治疗新选择"
FDA加速批准德达博妥单抗(Datopotamab Deruxtecan-dlnk,商品名Datroway)用于治疗EGFR突变非小细胞肺癌。了解这款TROP2靶向药的疗效、副作用、用法用量及海外代购信息,为肺癌患者提供新选择。 Read More... "德达博妥单抗获FDA加速批准:EGFR突变非小细胞肺癌治疗新突破"
深入了解IL-7/IL-7R在免疫系统中的关键作用,及其与癌症、自身免疫疾病的复杂关联。探索靶向IL-7/IL-7R的创新药物研发进展,包括针对白血病、非小细胞肺癌及自身免疫性疾病的免疫治疗新策略,为患者提供前沿用药信息。 Read More... "IL-7/IL-7R靶向药:癌症与自身免疫疾病的免疫治疗新进展"
SYMPATICO研究显示,伊布替尼联合维奈克拉作为套细胞淋巴瘤(MCL)一线治疗,尤其对老年患者及TP53突变患者,展现出高缓解率和持久疗效。了解伊布替尼、维奈克拉在MCL治疗中的最新进展,为您的海外购药提供参考。 Read More... "伊布替尼联合维奈克拉:套细胞淋巴瘤(MCL)一线治疗新突破,老年及TP53突变患者疗效显著"
深入了解小细胞肺癌免疫治疗的最新进展,包括Atezolizumab、Durvalumab等获批药物,以及Tarlatamab等新兴疗法。探索SCLC免疫治疗的挑战与未来方向,为患者提供海外靶向药代购及购药咨询。 Read More... "小细胞肺癌免疫治疗新篇章:Atezolizumab、Durvalumab等靶向药如何重塑SCLC治疗格局"
Sacituzumab tirumotecan (Sac-TMT)作为新型抗TROP2 ADC,在晚期三阴性乳腺癌及HR+/HER2−乳腺癌患者中展现显著疗效。了解其临床试验数据、客观缓解率与安全性,为癌症患者提供新希望。 Read More... "新型抗TROP2靶向药Sacituzumab tirumotecan:晚期乳腺癌治疗新突破,临床疗效与安全性深度解析"
最新ATHENA-MONO临床研究显示,卢卡帕利(Rucaparib)作为卵巢癌一线维持治疗,显著延长HRD阴性患者的无进展生存期。了解卢卡帕利在卵巢癌治疗中的重要作用及海外购药途径。 Read More... "卢卡帕利(Rucaparib)一线维持治疗:HRD阴性卵巢癌患者的生存新希望"
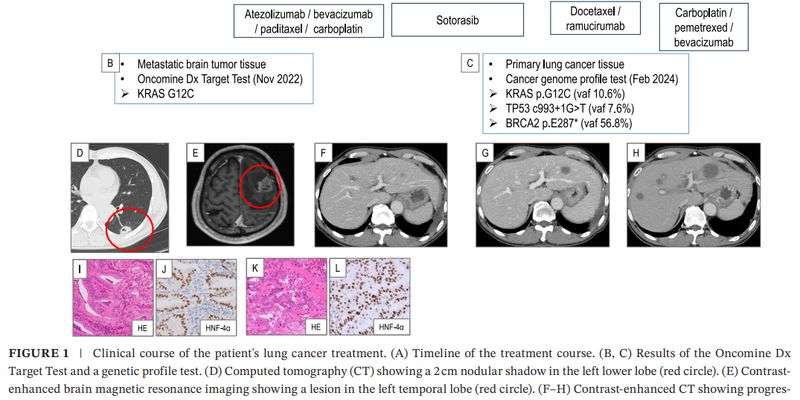
肺腺癌KRAS G12C突变患者索托雷塞治疗无效?深入解析p53/BRCA2共突变如何影响靶向药疗效。了解基因检测重要性,探索精准治疗新方案,海外购药选择。 Read More... "肺腺癌KRAS G12C靶向药索托雷塞无效?警惕p53/BRCA2共突变,基因检测助您精准抗癌"