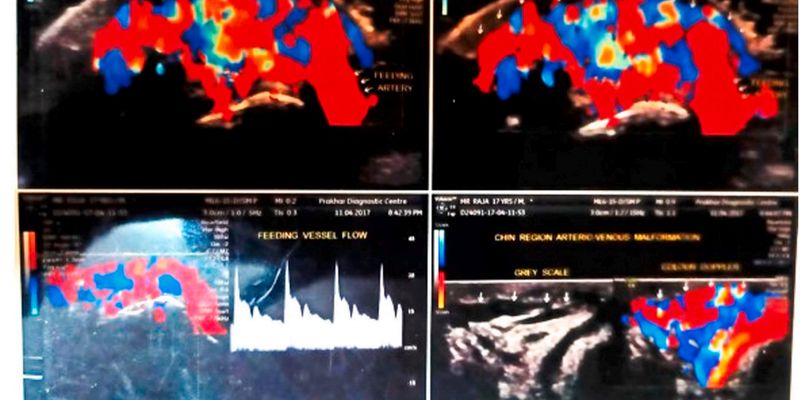
一个18岁患者的下巴肿块,最初被误诊为血管畸形,最终确诊为罕见的PTEN错构瘤。这篇文章深入探讨了PTEN基因突变如何显著增加乳腺癌、甲状腺癌等多种癌症的风险,并强调了进行PTEN基因检测对于早期癌症筛查和主动健康管理的重要性。了解您的遗传风险,可能改变您和家人的未来。 Read More... "下巴肿块竟是癌症信号?警惕PTEN错构瘤与遗传性肿瘤风险"
2025 ESMO年会公布妇科肿瘤最新研究成果。本文深入解读奥拉帕利、帕博利珠单抗等药物在卵巢癌、宫颈癌和子宫内膜癌治疗中的突破性进展,分析联合治疗方案的疗效与安全性,为患者提供前沿治疗资讯。想了解这些新药的价格和购买渠道吗?点击查看详情。 Read More... "2025 ESMO妇科肿瘤研究速递:奥拉帕利等新药如何改变卵巢癌、宫颈癌治疗格局?"
AtTEnd III期临床研究揭示,阿替利珠单抗(泰圣奇)联合化疗治疗晚期或复发性子宫内膜癌的最新数据。虽然总体生存期未达统计学显著差异,但在dMMR(错配修复缺陷)亚组中观察到显著的生存改善。点击了解该疗法对特定患者群体的突破性疗效、副作用及药物购买信息。 Read More... "AtTEnd研究新数据:阿替利珠单抗显著改善dMMR子宫内膜癌患者生存期"
最新研究揭示,脂肪长在哪里对癌症风险至关重要!并非所有脂肪都有害。研究证实,肝脏脂肪可使肝癌风险飙升超过4倍,而腹部皮下脂肪竟能将某些类型的乳腺癌风险显著降低57%。本文深入解读这项重磅研究,揭示不同部位脂肪与12种癌症的因果关系及其背后的分子机制,为癌症的精准预防提供全新视角。 Read More... "颠覆认知:并非所有脂肪都致癌!研究揭示肝脏脂肪与腹部脂肪对肝癌、乳腺癌风险的截然不同影响"
最新NRG GY018三期研究结果揭示,帕博利珠单抗联合化疗作为晚期或复发性子宫内膜癌的一线治疗方案,能显著延长患者的无进展生存期,且无论错配修复(MMR)状态如何均能获益。这一突破性进展为患者带来了新的希望。想了解更多关于帕博利珠单抗的治疗效果、副作用及代购信息吗? Read More... "帕博利珠单抗联合化疗:晚期子宫内膜癌一线治疗新突破,显著延长生存期"
最新PORTEC-3临床试验十年随访结果揭示,高危子宫内膜癌患者术后接受辅助放化疗,其总生存率和无复发生存率均优于单纯放疗。研究特别指出,P53异常的患者从联合治疗中获益最大。了解前沿治疗方案,为您的健康做出更优选择。 Read More... "子宫内膜癌新突破:辅助化疗显著提升高危患者十年生存率"
2024年美国病理学家协会(CAP)发布最新妇科肿瘤生物标志物检测指南,详细解读HER2、PD-L1、FOLR1等关键靶点。本文旨在帮助子宫内膜癌、卵巢癌患者理解检测报告,明确德曲妥珠单抗、索米妥昔单抗等靶向与免疫药物的适用条件,找到最有效的个性化治疗方案。 Read More... "2024妇科肿瘤精准治疗指南:读懂HER2/PD-L1检测,选对靶向药"
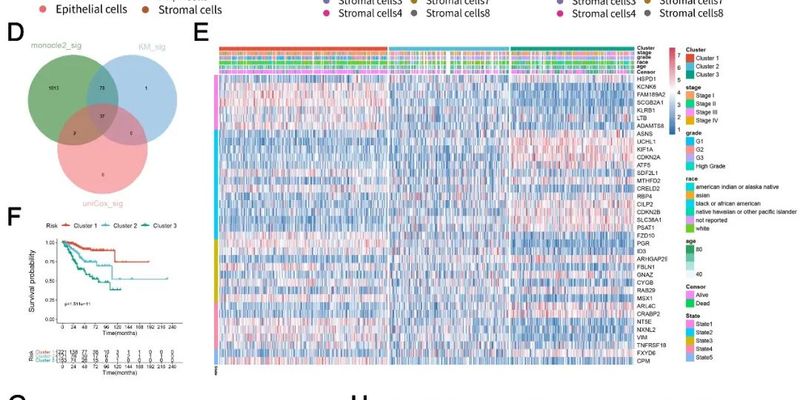
最新研究为子宫内膜癌(UCEC)患者带来新希望。通过单细胞测序技术,科学家构建了全新的风险分层系统,能更精准地评估预后。研究发现ARHGAP29和PGR是关键基因,为开发靶向药物和实现个体化精准治疗提供了重要线索。了解详情,探索前沿抗癌资讯。 Read More... "子宫内膜癌预后评估新突破:研究揭示ARHGAP29与PGR基因为关键,指导精准治疗新方向"
癌症并非无声无息,身体在确诊前一年常发出预警信号。本文深入解析胰腺癌、胃癌、食管癌、结直肠癌、白血病、淋巴瘤、肺癌等多种癌症的8大早期症状,如体重骤降、消化异常、持续疲劳等。了解这些关键信号,结合定期体检、健康生活方式,助您早发现、早干预,抓住癌症治疗的黄金期。 Read More... "警惕!癌症来临前身体的8大早期预警信号:胰腺癌、胃癌、肺癌等如何早发现?"
《柳叶刀》重磅研究揭示,绝经后ER+乳腺癌患者完成5年内分泌治疗后,继续延长芳香化酶抑制剂治疗5年,可显著降低27%复发风险,尤其对淋巴结阳性患者获益更大。了解乳腺癌延长治疗方案、副作用及购药途径,为您的抗癌之路提供最新科学依据。 Read More... "ER+乳腺癌患者福音:延长芳香化酶抑制剂治疗,复发风险显著降低27%"
曲妥珠单抗德鲁替康(Enhertu)获EMA验证,FDA已加速批准用于HER2阳性不可切除或转移性实体瘤。了解这款靶向药在结直肠癌、非小细胞肺癌等多种癌症中的显著疗效,以及海外购药途径。 Read More... "HER2阳性实体瘤治疗新突破:曲妥珠单抗德鲁替康(Enhertu)泛瘤种适应症获EMA验证与FDA批准"
深入了解卵巢癌治疗新进展:靶向药Mirvetuximab Soravtansine (Elahere)如何革新铂耐药FRα阳性卵巢癌患者的治疗选择,并探讨手术策略的演变。获取海外购药信息,为您的抗癌之路提供更多可能。 Read More... "卵巢癌治疗新突破:索米妥昔单抗 (Elahere)革新铂耐药患者治疗,手术策略同步演进"
Trastuzumab Pamirtecan在HER2阳性转移性乳腺癌III期临床中显示显著疗效,PFS优于T-DM1。了解这款靶向新药的最新进展、治疗优势及海外购药途径,为您的抗癌之路提供更多选择。 Read More... "靶向新药Trastuzumab Pamirtecan:HER2阳性转移性乳腺癌治疗新希望,PFS显著改善"
胆管癌FGFR2突变患者的治疗新希望!本文深入探讨厄达替尼、佩米替尼等FGFR靶向药在肝外胆管癌中的显著疗效,强调基因检测重要性。了解海外购药途径,获取最新靶向药信息,为您的抗癌之路提供支持。 Read More... "胆管癌FGFR2突变患者的治疗新突破:靶向药厄达替尼与佩米替尼的临床获益"
深入了解免疫检查点抑制剂(如帕博利珠单抗、替雷利珠单抗)在宫颈癌、子宫内膜癌、卵巢癌等妇科癌症中的真实世界疗效。本研究揭示MSI-H状态与免疫治疗的关联,为晚期妇科癌症患者提供新的治疗选择。探索海外靶向药代购,获取前沿抗癌方案。 Read More... "免疫检查点抑制剂在妇科癌症中的真实世界疗效:MSI-H与治疗新进展"
深入了解罕见且侵袭性强的子宫内膜癌肉瘤(ECS)的最新治疗进展。探索靶向药、免疫治疗如帕博利珠单抗、仑伐替尼、奥拉帕利及HER2靶向药物的疗效。获取ECS诊疗指南与海外购药信息,为患者提供希望。 Read More... "子宫内膜癌肉瘤治疗新突破:靶向药、免疫疗法与分子图谱深度解析"
深入了解51种常见肿瘤标志物,包括CEA、CA125、AFP等,它们在肺癌、肝癌、胃癌、乳腺癌、卵巢癌、胰腺癌、前列腺癌等多种癌症的早期诊断、治疗监测中的关键作用。助您全面掌握癌症诊断信息,为抗癌之路提供科学指引。 Read More... "癌症早筛与治疗:51种肿瘤标志物深度解析,助您精准抗癌"
探索Lunresertib与Camonsertib联合疗法在子宫内膜癌和卵巢癌中的突破性进展。了解PKMYT1抑制剂如何靶向CCNE1突变,改善患者预后。获取最新临床数据、副作用及海外购药信息,为您的抗癌之路提供新希望。 Read More... "Lunresertib联合Camonsertib:子宫内膜癌与卵巢癌靶向治疗新希望"
最新研究揭示,GLP-1受体激动剂(GLP-1RAs)或能显著降低肥胖或超重人群的总体癌症风险,尤其对卵巢癌、子宫内膜癌和脑膜瘤的预防效果显著。了解GLP-1RAs在癌症预防中的潜力,为癌症患者提供新的希望。MedFind提供海外靶向药代购服务。 Read More... "GLP-1受体激动剂:肥胖人群卵巢癌、子宫内膜癌等多种癌症风险的新希望"
Rina-S (rinatabart sesutecan)荣获FDA突破性疗法认定,为晚期子宫内膜癌患者带来新希望。RAINFOL™-01临床试验数据显示,该靶向药在经治患者中展现出良好疗效与可控安全性,有望成为新的治疗选择。了解更多关于Rina-S的最新进展及海外购药途径。 Read More... "Rinatabart Sesutecan (Rina-S) 获FDA突破性疗法认定:子宫内膜癌治疗新突破"