HPV阳性口咽癌治疗新方向:告别统一剂量,迈向精准放疗
由人乳头瘤病毒(HPV)引发的口咽鳞状细胞癌,在头颈部肿瘤中属于预后较好的一种亚型,患者的三年总生存率可超过90%。正是因为如此高的治愈率,临床研究的焦点逐渐转向如何在不影响疗效的前提下,减轻放射治疗带来的毒副作用。然而,近期多项试图统一降低放疗剂量的临床试验效果并不理想,部分研究甚至显示这种“一刀切”的降级策略可能增加治疗失败的风险。这暴露了传统治疗模式的根本局限:它假设所有HPV阳性口咽癌患者对放疗的敏感性相同,却忽视了肿瘤内部生物学的巨大差异。在此背景下,一项名为“基因组调整辐射剂量”(Genomically Adjusted Radiation Dose, GARD)的创新概念应运而生,它旨在通过分析肿瘤的基因表达特征,为每位患者量身定制最合适的放疗剂量,真正实现个性化治疗。对于这种前景广阔但仍存挑战的癌症,了解最新的治疗进展至关重要。您可以通过MedFind资讯中心获取更多前沿抗癌信息。

研究揭示:相同物理剂量,生物效应天差地别
一项发表于《临床研究杂志》(J Clin Invest)的国际多中心研究,纳入了191名接受根治性放疗的I-III期HPV阳性口咽癌患者。尽管他们接受的物理放疗剂量高度统一(大多为70戈瑞),但研究人员通过分析肿瘤样本的10基因特征计算出的GARD值却显示出惊人的异质性。数据显示,GARD值的范围从15.4到71.7,中位数仅为39.1。这一发现有力地证明,单纯的物理剂量无法反映肿瘤对治疗的真实生物学反应,凸显了个性化剂量调整的必要性。
GARD:超越传统分期的强大预后预测工具
该研究进一步证实了GARD在预测患者预后方面的卓越价值。生存分析结果显示:
- 独立预测能力: 在调整了肿瘤分期(T/N分期)、吸烟史等多个传统临床风险因素后,GARD是唯一与总生存期保持独立且显著相关的指标。
- 风险关联性: GARD值每增加一个单位,患者的死亡风险便相应下降约6%。在接受标准剂量治疗的患者亚组中,这一关联更为显著,风险下降幅度达到8%。
- 预测准确性: 在预测三年总生存率方面,单独使用GARD的模型其准确性(曲线下面积AUC为78.26)显著优于仅依赖临床变量的模型。当两者结合时,预测准确性更是提升至83.81。
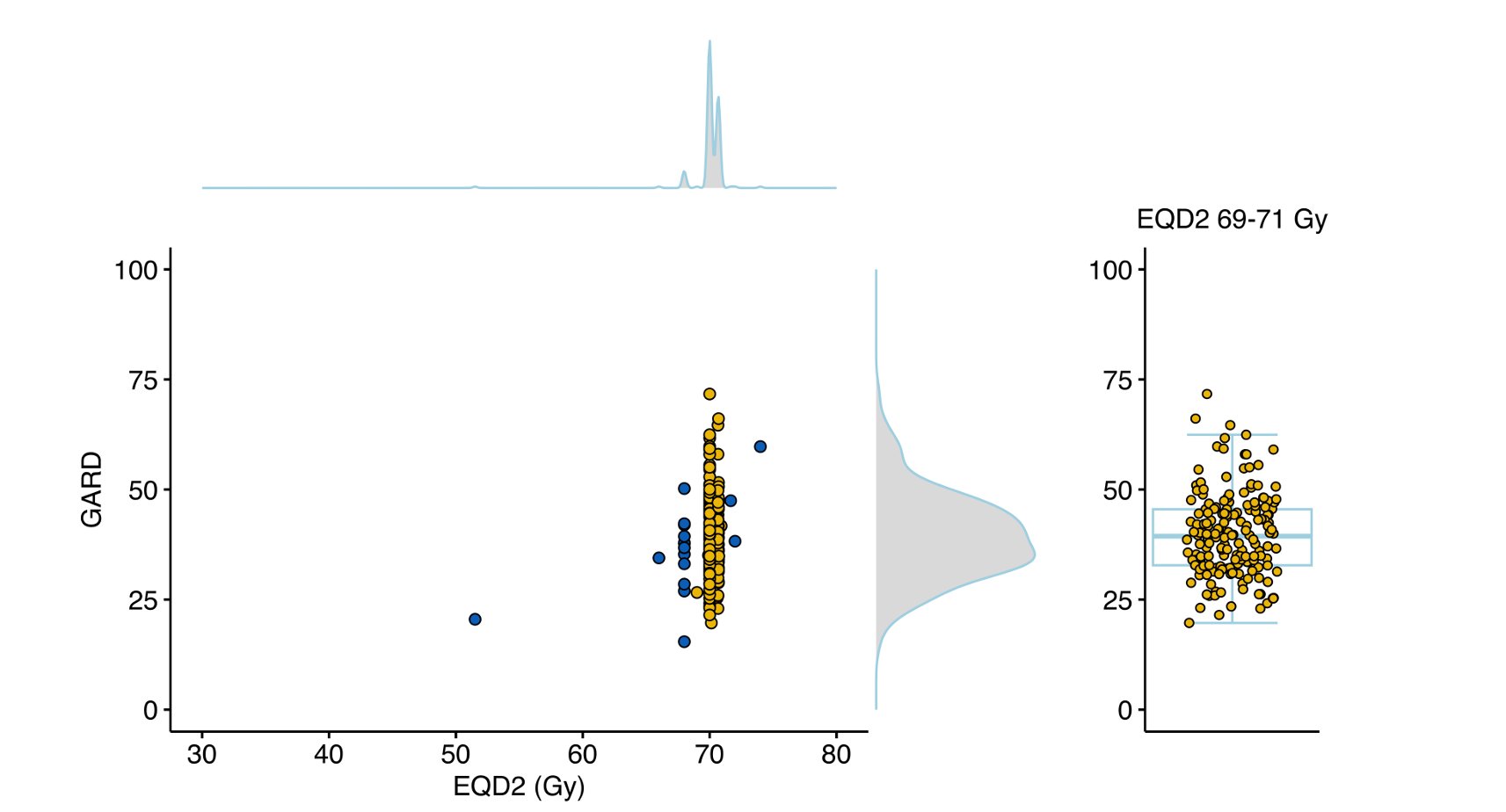
图1:基因组调整辐射剂量相较于单纯辐射剂量展现出辐射效应中更大的潜在基因组异质性
模拟试验:个性化剂量调整的未来图景
为了探索GARD在临床实践中的应用潜力,研究团队进行了计算机模拟临床试验。模拟结果清晰地展示了个性化策略的优势:
- 警示盲目降级: 若对所有患者统一将剂量降至60戈瑞,预测的三年生存率将有所下降,证实了无差别降级的风险。
- 实现安全降级: 若采用GARD指导的策略,仅对那些即便降低剂量GARD值仍能达标的患者(约占16%)进行降级,他们的生存曲线与接受标准治疗的患者完全一致,实现了“安全降级”。
- 开创个性化处方: 更具革命性的是,研究提出了一个以达到特定GARD目标值为导向的全新治疗范式。在该模式下,约77.7%的患者可以安全地降低放疗剂量,平均减少约5次照射(缩短一周治疗时间);而另外22.3%的放疗抵抗型患者则被精准识别出来,需要接受更高剂量的强化治疗以确保疗效。
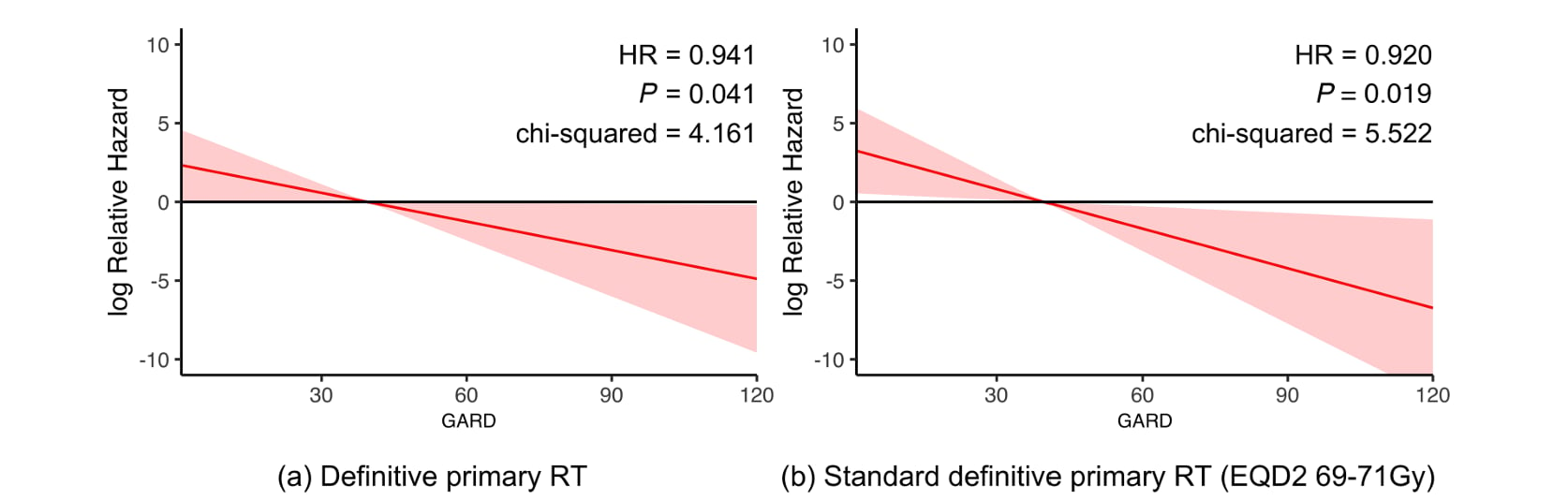
图2:基因组调整辐射剂量是接受放疗的HPV阳性口咽鳞状细胞癌患者总生存期的连续预测因子
总结与展望
总而言之,这项研究不仅确立了GARD作为HPV阳性口咽癌预后预测的优越工具,更重要的是,它为如何将这一工具整合到临床决策中,实现放疗剂量的真正个性化,提供了清晰的路线图。这标志着头颈部肿瘤的放射治疗正从“经验医学”迈向“精准医学”的新时代。未来,基于GARD的个性化处方有望在维持高治愈率的同时,大幅降低治疗带来的急性和晚期毒性,显著改善患者的生活质量。若您对口咽癌的个性化治疗方案或最新的临床研究有任何疑问,不妨尝试使用MedFind的AI问诊服务,获取专业的解答和指导。