引言
抗体-药物偶联体(Antibody-Drug Conjugates, ADCs)作为一种创新的“生物导弹”,为肺癌、乳腺癌、卵巢癌等多种癌症的治疗带来了革命性突破。它能将强效化疗药物精准地投送到肿瘤细胞,实现高效杀伤的同时,理论上能减少对健康组织的伤害。然而,在临床应用中,许多患者仍会经历各种预期之外的副作用,如眼部不适、血液指标异常等。这些副作用的根源是什么?我们又该如何更好地管理这些风险呢?一篇发表于《Journal of Hematology & Oncology》的最新研究,为我们深入解析了ADC药物副作用背后的秘密。

研究概览:从真实世界数据看ADC的安全性
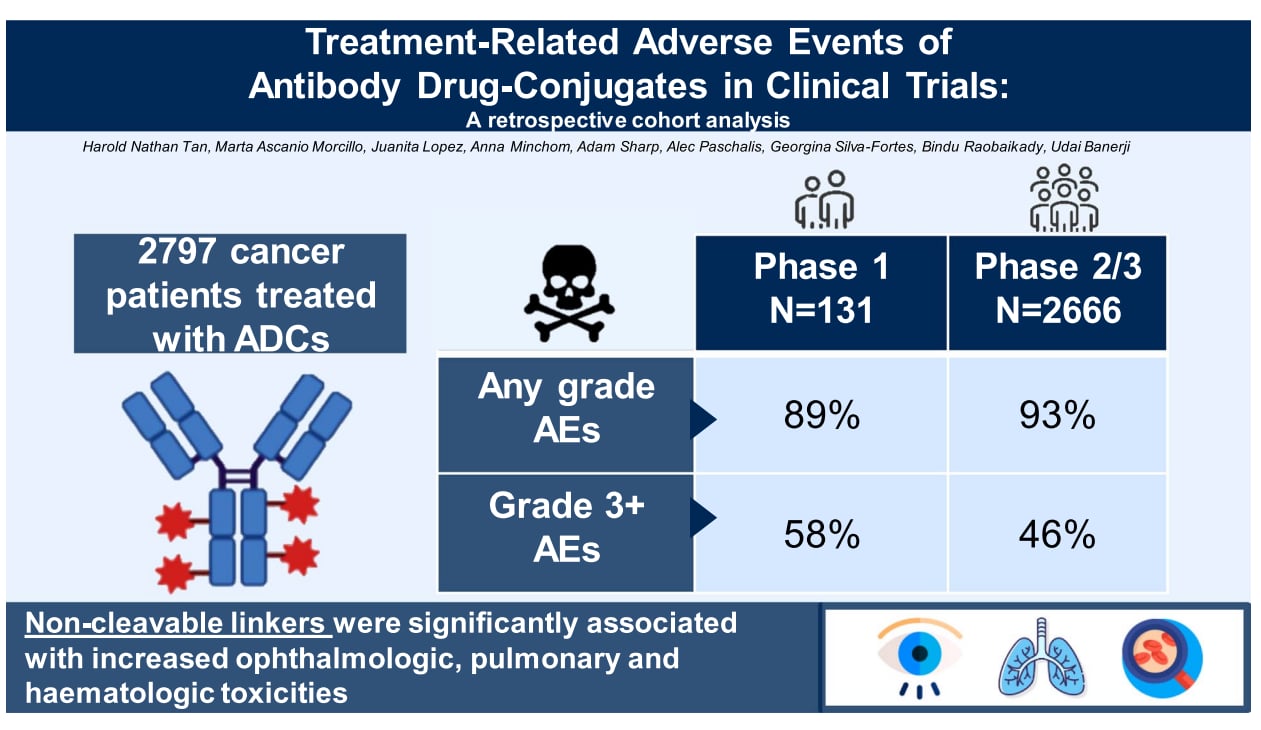
为了系统性地探究ADC药物的毒性来源,研究人员回顾性分析了2014至2024年间,在英国皇家马斯登医院参与早期临床试验的131名患者数据,并将其与FDA批准的15个关键临床注册试验中2666名患者的安全性数据进行了对比。通过严谨的统计学分析,该研究旨在揭示ADC药物的各个结构“零件”——包括抗体类型、连接子、载药(化疗药)类型以及载药量(DAR)——是如何具体影响其副作用谱的。
关键发现:ADC的“零件”如何决定毒性?
研究发现,几乎所有接受ADC治疗的患者都会经历至少1级的不良事件,近半数患者甚至会出现3级以上的严重不良事件。通过多变量分析,研究人员找到了特定副作用与ADC结构之间的显著关联:
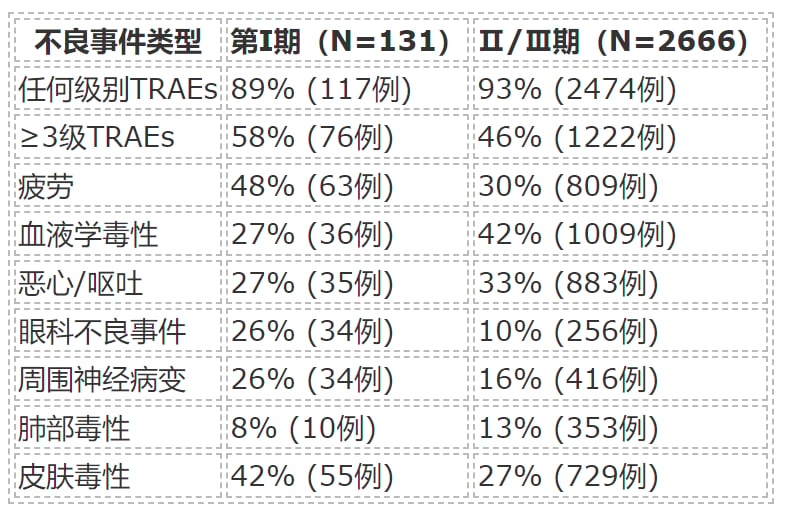
- 眼科毒性:研究发现,非可裂解连接子是导致眼部副作用风险增加的唯一显著因素。这类连接子虽然在血液中更稳定,但其代谢产物可能更容易在眼角膜等敏感组织中积聚,引发损伤。
- 肺部毒性:与肺部不良事件风险升高相关的因素包括 IgG1抗体、非可裂解连接子以及较高的载药量(DAR>4)。这表明抗体的免疫效应、连接子的稳定性以及药物的浓度都可能协同作用,增加肺部损伤的风险。
- 血液学毒性:非可裂解连接子和高载药量(DAR>4)同样显著增加了血液系统不良事件的风险。特别是高DAR值,使血液毒性风险剧增近18倍,提示载药量是影响骨髓抑制等副作用的关键。
- 神经病变:周围神经病变(如手脚麻木)与靶向微管的载药(如MMAE、MMAF)有极强的关联性。这类化疗药本身就具有神经毒性,当通过ADC递送时,这种副作用也随之而来,对于曾接受过紫杉类或铂类化疗的患者,风险可能更高。
对患者的启示:理解并管理ADC治疗风险
这项研究的结果不仅为未来的ADC药物研发指明了方向,也为正在接受或考虑ADC治疗的患者提供了宝贵的参考。了解您所使用的ADC药物的具体构造,有助于您和医生共同预测并管理潜在的副作用:
- 关注药物“零件”:在开始治疗前,可以向您的医生了解所用ADC药物的连接子类型、载药种类和DAR值。例如,若药物使用非可裂解连接子,应更加关注眼部健康和定期检查。
- 警惕累积效应:对于使用微管靶向载药的ADC,需警惕神经毒性的发生和加重,特别是如果您之前用过其他有神经毒性的化疗药。
- 平衡疗效与风险:高DAR值虽然可能带来更强的抗肿瘤效果,但也伴随着更高的血液和肺部毒性风险。理解这种平衡有助于您在治疗过程中做出更明智的决策。
总而言之,抗体-药物偶联体(ADC)的设计是一门精密的科学。通过深入理解其结构与功能的关系,我们可以更好地预测和管理其副作用,从而在最大化治疗效益的同时,将风险降至最低,为癌症患者争取更优的生存质量和治疗前景。