三阴性乳腺癌治疗挑战与免疫疗法瓶颈
三阴性乳腺癌(TNBC)因其侵袭性强、复发率高且缺乏常规靶向治疗方案,一直是临床治疗的难点。近年来,以PD-1/PD-L1抑制剂为代表的免疫疗法为癌症治疗带来了曙光,但其效果在TNBC中仍不尽人意。传统免疫疗法主要依赖CD8+ T细胞(“杀手T细胞”)来攻击癌细胞,但在狡猾的肿瘤微环境中,这些“杀手”容易变得“筋疲力尽”,甚至被肿瘤细胞“隐身”躲避,导致治疗效果大打折扣。
创新思路:唤醒“指挥官”CD4+ T细胞
为了突破这一困境,中国科学院杭州医学所的谭蔚泓院士和吴芩研究员团队将目光投向了另一类关键的免疫细胞——CD4+ T细胞。CD4+ T细胞如同免疫系统中的“指挥官”,不仅能辅助“杀手T细胞”作战,还能直接参与攻击,并在调动整个免疫系统中扮演核心角色。然而,如何有效地将这些“指挥官”招募到肿瘤内部并激活它们,是当前面临的主要挑战。
为此,研究团队开发了一种极具创意的细胞平台——CD4适配体工程化的液氮处理癌细胞系统(AptCD4-LNTs)。这项发表于《Cell Biomaterials》的研究,为激活针对三阴性乳腺癌的抗肿瘤免疫力提供了全新的策略。

AptCD4-LNTs平台如何工作?
这个平台的工作原理可以通俗地理解为“特洛伊木马”策略:
- 构建“木马”:研究人员首先获取TNBC癌细胞,通过液氮快速冷冻处理,使其失去增殖能力但保持细胞结构的完整性(即LNTs),确保其安全性。
- 安装“GPS导航”:接着,他们在这些处理过的癌细胞表面,通过化学方法装上一种名为“CD4适配体”的特殊分子。这个适配体就像一个精准的钩子,能够特异性地识别并结合CD4+ T细胞。
- 精准“投送”:将构建好的AptCD4-LNTs平台注入体内后,由于LNTs本身具有回归肿瘤的特性,它们会像自带导航的“木马”一样,携带“钩子”精准地聚集到肿瘤部位。
- 激活免疫大军:到达肿瘤后,平台上的“钩子”会大量捕获并激活CD4+ T细胞,将这些“指挥官”集结到前线。被激活的CD4+ T细胞会释放信号(如IL-2、IFN-γ等),唤醒并调动自然杀伤(NK)细胞、B细胞、树突状细胞等更多免疫细胞,形成协同作战网络,共同围剿癌细胞。
对于这些前沿疗法的复杂机制,患者可能有很多疑问。我们建议您咨询MedFind的AI问诊服务,获取更专业的个性化解读。
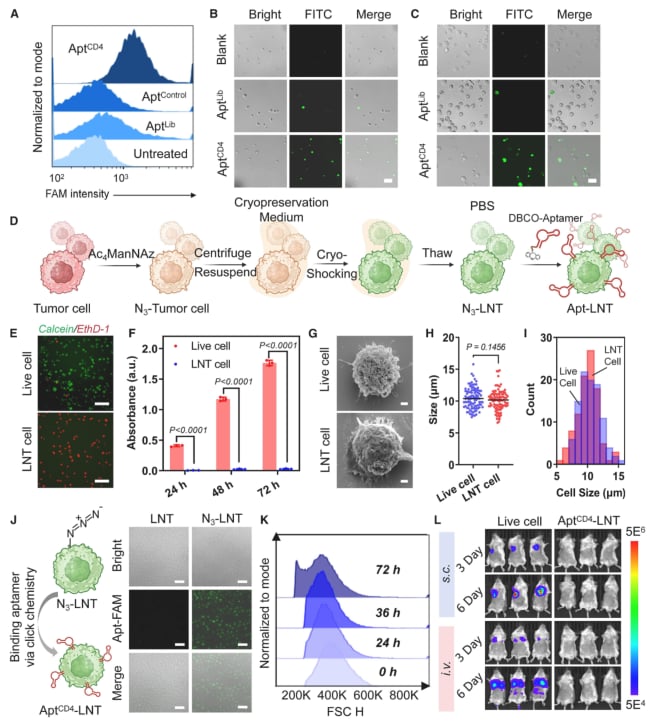
图1:AptCD4-LNTs平台的构建与验证。研究证明该平台能稳定构建,且处理后的癌细胞失去增殖能力,确保了治疗的安全性。
研究结果:显著的抗肿瘤效果与良好安全性
在针对TNBC小鼠模型的实验中,AptCD4-LNTs平台展现了令人鼓舞的治疗效果:
- 显著抑制肿瘤生长:治疗组的肿瘤体积较对照组减少了高达3.9倍。
- 延长生存期:接受治疗的小鼠生存期得到有效延长。
- 抑制肺转移:该疗法还成功抑制了肿瘤向肺部的转移。
- 安全性高:在整个治疗过程中,未观察到明显的体重下降或主要器官损伤,显示出良好的安全性。
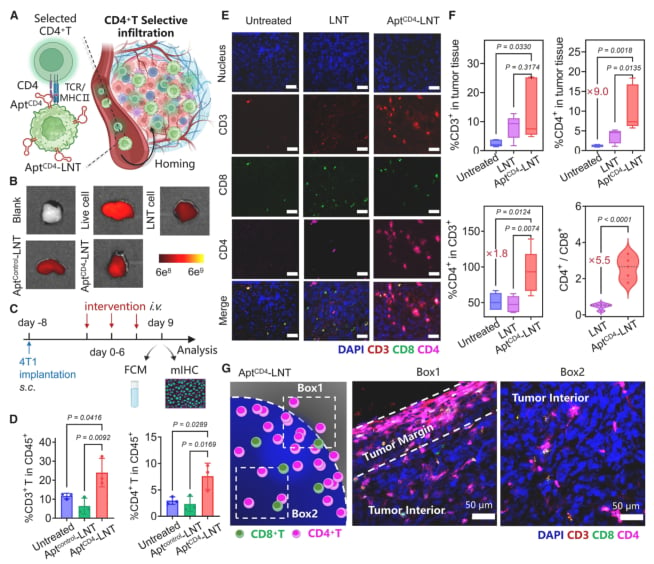
图2:AptCD4-LNTs平台能有效招募CD4+ T细胞浸润至肿瘤组织,尤其是在抗肿瘤的关键区域——肿瘤边缘。
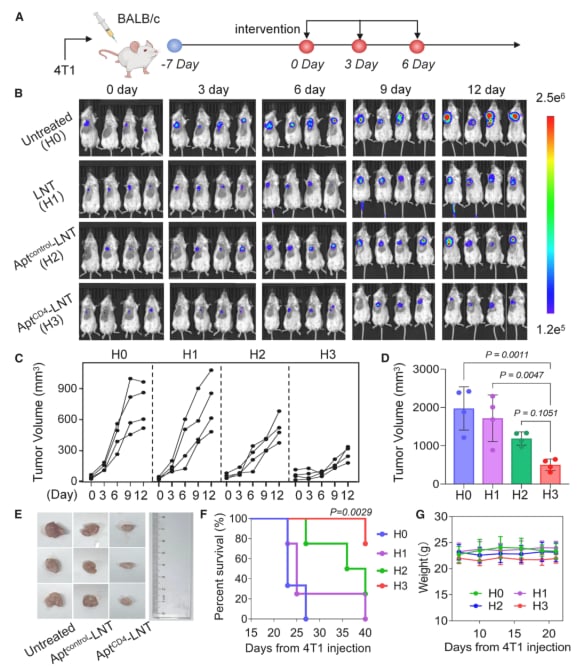
图3:实验数据显示,AptCD4-LNTs治疗组(红色曲线)的肿瘤生长受到显著抑制。
未来展望:为“冷肿瘤”治疗开辟新途径
这项研究通过单细胞测序技术深入揭示了AptCD4-LNTs重塑肿瘤免疫微环境的详细机制,证实了激活CD4+ T细胞在抗肿瘤免疫中的核心作用。总而言之,AptCD4-LNTs平台通过精准招募和激活CD4+ T细胞,成功地将免疫抑制性的“冷肿瘤”微环境转变为免疫细胞活跃的“热肿瘤”微环境,为三阴性乳腺癌乃至其他实体瘤的免疫治疗提供了极具潜力的新策略。
虽然这项技术距离临床应用还有一段路要走,但它无疑为攻克TNBC等难治性癌症点亮了新的希望。未来,通过进一步优化或联合其他疗法(如免疫检查点抑制剂),有望取得更佳的治疗效果。想了解更多关于三阴性乳腺癌的最新治疗方案,可以访问MedFind抗癌资讯板块。同时,对于已获批的靶向药和免疫药物,您可以通过MedFind海外靶向药代购平台,便捷地获取全球前沿的治疗选择。
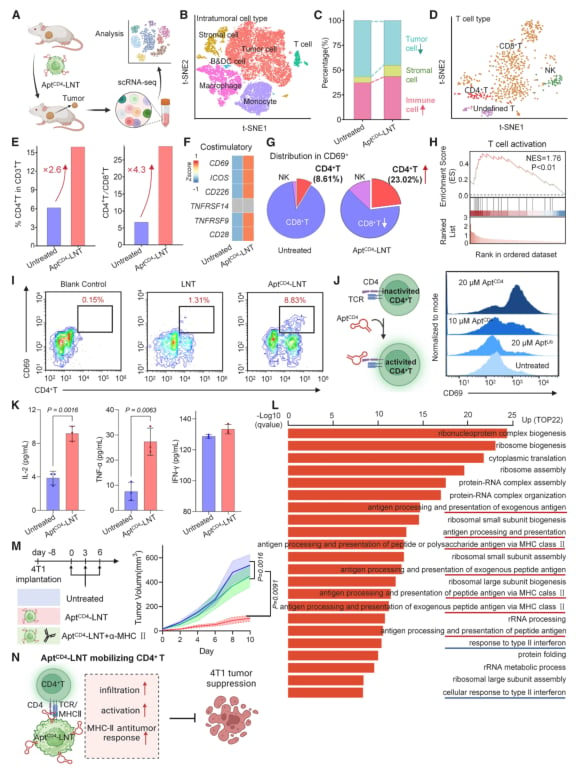
图4:单细胞分析揭示,AptCD4-LNTs能显著增加肿瘤内CD4+ T细胞的比例并上调其激活标志物。
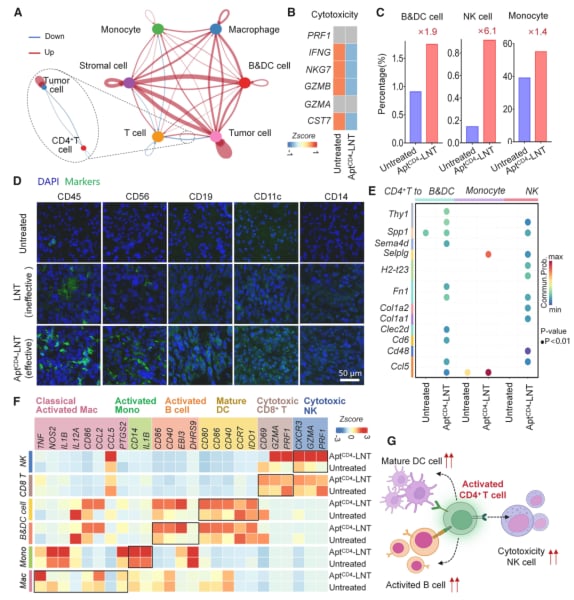
图5:研究表明,激活的CD4+ T细胞通过增强与其他免疫细胞(如B细胞、NK细胞)的相互作用,形成协同抗肿瘤网络。





