深入理解EGFR突变肺癌:超越激酶活性的新发现
EGFR突变是非小细胞肺癌(NSCLC)中最常见的驱动基因突变之一,通常导致EGFR受体的持续激活,进而促进癌细胞的异常增殖。针对EGFR激酶活性的靶向药物,如厄洛替尼和阿法替尼,在治疗EGFR突变肺癌方面取得了显著成效。然而,许多患者最终会产生耐药性,且仅抑制激酶活性可能不足以完全控制肿瘤生长。这提示我们,EGFR在癌细胞的生存和进展中可能扮演着更复杂、甚至独立于其激酶角色的功能。
研究揭示:溶酶体EGFR的激酶非依赖性功能
近期发表在《Cell Research》上的一项重要研究,由中山大学、中国科学院大学、南方医科大学等机构的科学家团队共同完成,为我们揭示了EGFR在mTORC1激活中的一个全新、且不依赖于其激酶活性的功能。研究发现,当EGFR定位在细胞内的溶酶体上时,它可以物理结合并充当Rheb蛋白的鸟嘌呤交换因子(GEF)。简单来说,EGFR在溶酶体上直接“开启”了Rheb,进而激活了细胞生长的关键调控中心——mTORC1。
这一发现意义重大,因为它揭示了EGFR激活mTORC1的另一条独立通路,解释了为何仅仅阻断EGFR的激酶活性可能无法完全抑制肿瘤生长。研究通过构建EGFR-E804K突变体(该突变会降低EGFR的GEF活性),发现其显著抑制了Rheb的激活以及下游mTORC1的活性,从而抑制了细胞增殖和肿瘤生长。
现有靶向药的再审视:阿法替尼的独特之处
研究进一步对比了不同EGFR靶向药对这一新发现机制的影响。结果显示,第一代EGFR-TKI厄洛替尼主要靶向激酶活性,对EGFR的Rheb-GEF功能影响较小,因此对mTORC1激活的抑制相对有限。而第二代EGFR-TKI阿法替尼则表现出更广泛的作用,它不仅能阻断EGFR的激酶活性,还能额外抑制其Rheb-GEF活性。这可能部分解释了为何在某些情况下,阿法替尼能带来更强的细胞生长抑制效果。
未来方向:靶向EGFR GEF功能的新策略
基于这一突破性发现,研究团队提出了一种对抗EGFR突变癌症的“有前途的策略”——同时靶向EGFR的激酶活性和Rheb-GEF活性。他们设计了一种新型小分子化合物BIEGi-1,该分子被设计用于同时抑制EGFR的这两项关键功能。实验结果表明,BIEGi-1对携带EGFR突变体的癌细胞表现出强烈的抑制作用。

这项研究不仅揭示了癌细胞生长的一个基本分子事件,更为开发下一代EGFR靶向药提供了全新的思路。未来,针对EGFR激酶和GEF双重功能的药物,有望为EGFR突变肺癌患者带来更持久、更深入的治疗应答。
对于面临EGFR突变肺癌挑战的患者,了解最新的靶向治疗进展至关重要。如果您正在寻找合适的靶向药或仿制药,可以考虑通过MedFind海外靶向药代购服务获取。面对复杂的癌症信息和治疗选择,专业的指导非常有益。MedFind的AI问诊服务可以为您提供初步的智能咨询,帮助您更好地理解病情和潜在治疗方案。MedFind网站还提供丰富的药物信息和诊疗指南,帮助患者和家属获取全面的抗癌资讯。
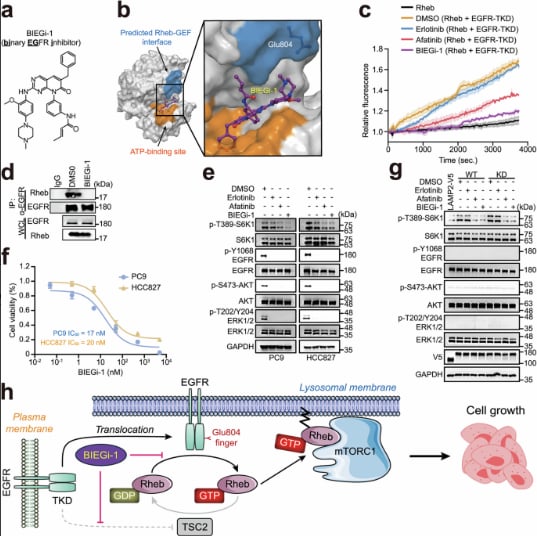
图1 BIEGi-1抑制癌细胞生长(摘自《Cell Research》)


![[肿瘤创新药] FDA批准N17350临床申请:开启ELANE通路抗癌新时代,晚期实体瘤患者迎来新希望 4 [肿瘤创新药] FDA批准N17350临床申请:开启ELANE通路抗癌新时代,晚期实体瘤患者迎来新希望](https://medfind.link/wp-content/uploads/2026/02/bcf08099a9dc340b71f5850bc98d4872.jpg)