胰腺导管腺癌(PDAC),通常被称为胰腺癌,是一种极具侵袭性的恶性肿瘤,患者的五年生存率极低,迫切需要更有效的治疗方法。癌细胞为了维持其快速增殖,往往比正常细胞更依赖于精确的基因表达调控,其中RNA剪接过程扮演着至关重要的角色。近期,一项研究聚焦于一种名为末端尿苷酰转移酶1(TUT1)的酶,揭示了它在胰腺癌细胞生存中的独特作用。
胰腺癌治疗的挑战与新靶点的探索
胰腺癌因其早期诊断困难、易转移以及对常规化疗药物的抵抗性,成为医学界面临的严峻挑战。目前,针对胰腺癌的有效靶向治疗和免疫治疗手段仍然有限。因此,寻找并验证新的治疗靶点,对于改善胰腺癌患者的预后至关重要。
TUT1:调控剪接的关键酶
TUT1是一种特殊的酶,负责在U6小核RNA(snRNA)的末端添加尿苷酸。U6 snRNA是剪接体(执行RNA剪接的分子机器)的核心组分之一。TUT1的这一功能对于U6 snRNA的成熟和后续组装成剪接体复合物(特别是U4/U6.U5三小核核糖核蛋白颗粒,tri-snRNP)至关重要。

TUT1在胰腺癌细胞中的独特作用
清华大学陈默团队的研究发现(原发表于Cancer Research),TUT1对于胰腺癌(PDAC)细胞的生存是必需的,但对于正常的胰腺细胞则不然。这提示TUT1可能成为一个具有选择性的治疗靶点。
研究进一步揭示,在PDAC细胞中,TUT1通过其酶活性促进LSM蛋白与U6 snRNA的结合,进而高效地组装tri-snRNP。为什么PDAC细胞如此依赖TUT1呢?因为癌细胞的转录活动异常旺盛,产生了大量需要剪接的前体mRNA,其中许多含有“弱剪接位点”,需要更多的tri-snRNP才能被有效处理。TUT1恰好满足了PDAC细胞对高水平tri-snRNP的需求。
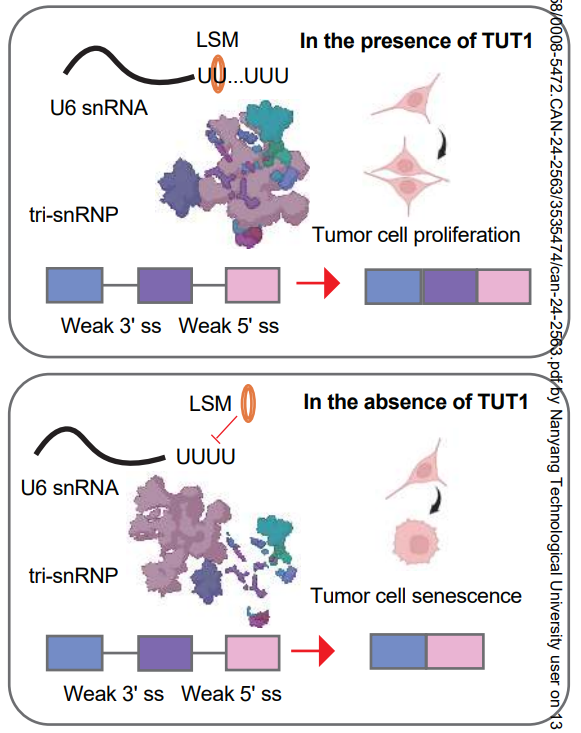
靶向TUT1抑制胰腺癌细胞生存的模式机理图
靶向TUT1的潜在治疗意义
该研究表明,如果在PDAC细胞中抑制或耗尽TUT1,会导致含有弱剪接位点的高表达RNA剪接效率降低,破坏mRNA的正常加工流程,最终引发剪接失调,抑制癌细胞的生存。这种对癌细胞的选择性杀伤作用,使得靶向TUT1成为一种有前景的胰腺癌治疗策略。
这项研究不仅阐明了TUT1在剪接调控中的新功能,也揭示了胰腺癌细胞对剪接过程的特殊依赖性(剪接成瘾)。未来,开发针对TUT1的小分子抑制剂或其它靶向疗法,可能为胰腺癌患者带来新的希望。对于关注前沿疗法的患者而言,了解这些新兴靶点及其相关的药物研发进展非常重要。若您希望探索更多治疗选择或了解海外新药的获取途径,MedFind可提供相关信息支持。同时,复杂的病情和治疗方案往往需要专业解读,您也可以考虑使用AI问诊服务进行初步咨询。
总结
总而言之,清华大学团队的研究强调了TUT1作为胰腺癌(PDAC)潜在治疗靶点的重要性。通过深入理解TUT1在调控剪接和维持癌细胞生存中的关键作用,为开发更有效、更具选择性的胰腺癌新疗法开辟了新的道路。随着研究的深入,我们期待基于TUT1靶点的治疗方案能早日进入临床,惠及更多胰腺癌患者。