引言
肺癌是全球范围内发病率和死亡率都名列前茅的恶性肿瘤。对于许多晚期肺癌患者而言,疼痛是伴随疾病进展的常见且棘手的症状。虽然世界卫生组织(WHO)的三阶梯镇痛原则和NCCN成人癌痛指南推荐的规范化药物治疗(包括阿片类药物如羟考酮、吗啡,以及辅助镇痛药和骨转移相关药物如唑来膦酸、地舒单抗等)能够缓解大部分患者的疼痛,但仍有部分患者会发展为难治性癌痛——即经过规范药物治疗后疼痛控制仍不满意,或出现无法耐受的副作用。
难治性癌痛严重影响患者的生活质量,是临床医生面临的一大挑战。幸运的是,近年来微创介入治疗技术取得了长足进步,为这些患者带来了新的希望。本文将全面总结和解析多种用于晚期肺癌难治性癌痛的微创介入治疗策略,旨在为患者和医生提供有价值的参考。对于癌症治疗方案及药物选择,患者也可考虑使用MedFind AI问诊获取初步建议。
什么是难治性癌痛?
难治性癌痛通常指由肿瘤本身或其治疗引起的中、重度疼痛,在经过1-2周规范化药物治疗后,疼痛缓解效果依然不佳,或者患者无法耐受药物带来的不良反应。
微创介入治疗:难治性癌痛的“利器”
针对难治性癌痛,多种微创介入技术应运而生,它们通过不同的机制直接作用于疼痛产生的部位或传导通路,以达到有效镇痛的目的。主要技术包括:
1. 患者自控镇痛泵技术(PCA)
PCA技术允许患者根据自身疼痛程度,通过一个预设好药物剂量(如吗啡、芬太尼等阿片类药物)的设备,自行控制镇痛药的输注。这赋予了患者管理自身疼痛的主动权。
- 类型: 临床常用电子泵,可灵活调整参数(负荷剂量、背景剂量、单次追加剂量、锁定时间、最大剂量)。
- 模式: 分为单纯PCA(仅按需给药)和持续输注PCA(背景持续给药+按需追加)。
- 途径: 最常用的是静脉PCA(PCIA)和皮下PCA(PCSA)。
- 前景: 未来结合人工智能的PCA泵有望实现更智能化的疼痛管理,提高居家使用的便利性。
2. 经皮椎体强化技术
晚期肺癌常发生骨转移,尤其是脊柱转移,可能导致椎体压缩性骨折(VCF)和剧烈疼痛。经皮椎体强化技术通过向受损椎体内注入“骨水泥”来稳定椎体、缓解疼痛。
- 经皮椎体成形术(PVP): 直接向病变椎体注入骨水泥,操作相对简单快速。
- 球囊扩张椎体后凸成形术(PKP): 先用球囊扩张被压缩的椎体,形成空腔后再注入骨水泥,有助于恢复椎体高度和改善脊柱稳定性。
PVP和PKP的选择需根据患者具体情况(如椎体压缩程度、是否需要恢复高度、经济条件等)决定。下表总结了两者的主要区别:
表1 PVP 与PKP 在晚期肺癌伴骨转移治疗中的区别
| 比较项目 | PVP | PKP |
| 适应症 | 晚期肺癌椎体转移引起的顽固性癌痛,CT提示溶骨性病变且椎体高度无明显变小,椎体后壁相对完整,需快速缓解疼痛,尤其适合全身状况差者。 | 晚期肺癌椎体转移伴明显椎体压缩性骨折(椎体塌陷≤原高度 2/3),需恢复椎体高度改善稳定性,或矫正后凸畸形缓解神经根压迫。 |
| 禁忌症 | 椎体后壁或侧壁骨皮质严重破坏,椎体压缩高度>70%,肿瘤侵犯椎管或合并脊髓压迫。 | 椎体完全塌陷呈扁平椎,成骨性转移瘤或椎管内有软组织肿块。 |
| 手术方式 | 直接经皮穿刺注入骨水泥,无需球囊扩张,时间较短(约30-45分钟)。 | 先球囊扩张恢复椎体高度并形成空腔,再低压注入骨水泥,时间较长(约60-90分钟)。 |
| 镇痛效果 | 术后24小时内疼痛缓解率高(80%-90%),适合需快速镇痛者。 | 癌痛缓解效果与PVP相当,但能通过恢复椎体高度改善神经根性疼痛。 |
| 脊柱稳定性 | 稳定性较PKP差。 | 恢复部分椎体高度,矫正率可达50%,降低邻近椎体再骨折风险,更适合预期生存期较长者。 |
| 并发症 | 骨水泥渗漏率较高(约5%-10%)。 | 球囊形成空腔使骨水泥渗漏率降低(约1%-5%)。 |
| 费用和适用性 | 费用相对较低,适合经济条件有限或需多椎体治疗者。 | 因需球囊等耗材,费用较高,推荐用于单发转移灶且预期生存期>6个月者。 |
| 优选建议 | 癌痛剧烈需立即缓解,椎体结构破坏较轻,多发转移需控制成本者优选PVP。 | 椎体塌陷致后凸畸形或神经压迫,溶骨破坏范围大但未累及椎管,需降低渗漏风险者优选PKP。 |
3. 经皮消融技术
通过物理方法(热或冷)直接摧毁引起疼痛的肿瘤组织或神经末梢。
- 热消融:射频消融(RFA): 利用射频电流产生高温(>100℃)使肿瘤细胞凝固坏死。优点是控温较精准,对周围神经损伤相对较小,适合较小或敏感区域病灶。缺点是消融范围有限。
- 微波消融(MWA): 利用微波使水分子高速摩擦产热(60-150℃)。优点是升温快、穿透性强、消融范围更大更均匀、受血流影响小,适合较大(≤5cm)或血供丰富的病灶。缺点是高温可能影响周围神经。
- 高强度聚焦超声(HIFU,海扶刀): 体外发射超声波,精准聚焦于体内肿瘤靶点,产生高温(60-100℃)及其他效应使组织坏死。优点是完全无创、精准。缺点是对骨骼遮挡或含气病灶效果差。
- 低温消融(冷冻消融,CA): 利用极低温(-40℃至-100℃)冷冻肿瘤组织,导致细胞内外冰晶形成、细胞膜破裂、微血管损伤、缺血坏死,并可能激发抗肿瘤免疫。优点是能形成清晰的冰球边界,便于监测,对邻近重要结构(如神经)损伤风险较低,术后急性疼痛较轻。
选择哪种消融技术需综合考虑肿瘤大小、位置、邻近结构、患者状况等因素。下表对比了几种常用消融技术:
表2 射频消融、微波消融、冷冻消融以及高强度聚焦超声消融的比较
| 比较项目 | 射频消融 | 微波消融 | 冷冻消融 | 高强度聚焦超声消融 |
| 作用机理 | 射频电流热效应致凝固坏死 | 高频电磁波摩擦产热致凝固坏死 | 极低温冷冻致细胞/组织坏死 | 超声聚焦产生热/空化/机械效应致凝固坏死 |
| 适合肿瘤病灶特征 | 直径<3cm,远离大血管 | 直径较大(5-8cm),血供丰富 | 邻近神经或重要器官 | 深部病灶 |
| 创伤性 | 微创(经皮穿刺) | 微创(经皮穿刺) | 微创(经皮穿刺) | 完全无创 |
| 优势 | 快速减轻压迫性疼痛 | 升温快,消融范围均匀,减少术中痛 | 破坏痛觉神经末梢,快速缓解,术后急性痛轻 | 无创,精准,恢复快 |
| 缺点 | 范围有限,可能需多次;短期或加重神经痛 | 高温可能致短暂灼痛 | 冷冻-复温循环可能致短暂胀痛 | 对骨骼遮挡或含气病灶效果差 |
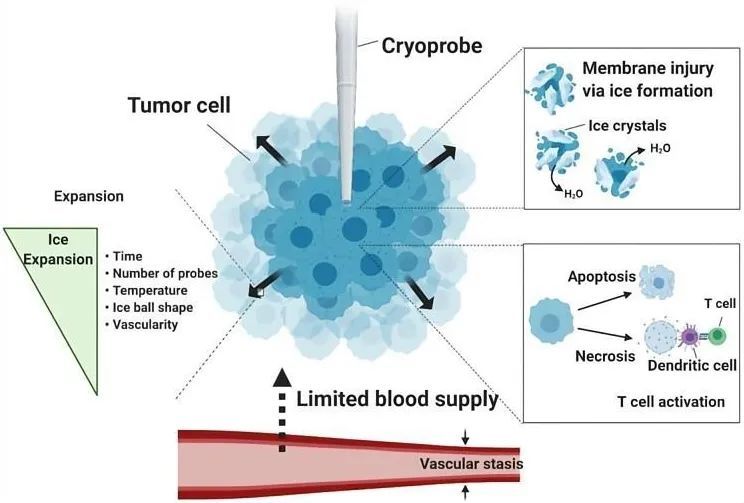
图1:冷冻消融的作用机制
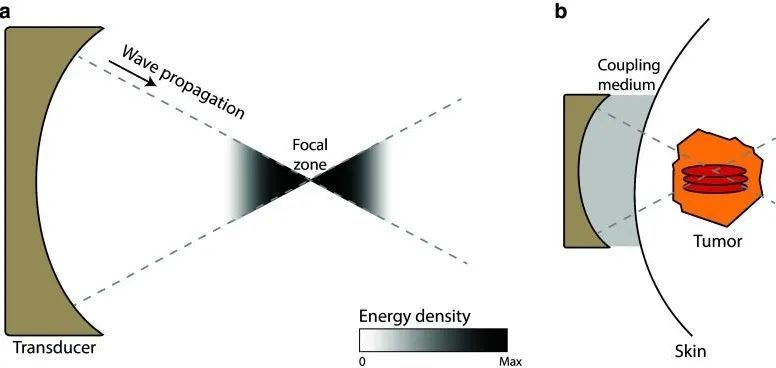
图2:高强度聚焦超声消融的作用示意图
4. 脊髓电刺激(SCS)
通过植入脊髓硬膜外隙的电极,利用脉冲电流刺激特定的神经纤维(A-β粗纤维),根据“闸门控制学说”及其他复杂机制(涉及GABA、5-HT、胆碱能、阿片能系统等),抑制疼痛信号向大脑传递。
- 优势: 微创可逆、对部分慢性顽固性疼痛(包括某些癌痛)有效、无药物副作用、参数可调、改善生活质量。
- 适用: 尤其适用于常规止痛方法效果不佳的顽固性疼痛,对于预期生存期>3个月的晚期肺癌患者,若其他疗法无效,可考虑SCS。
- 类型: 有多种刺激模式(传统、高频、爆发式、闭环等)可供选择。
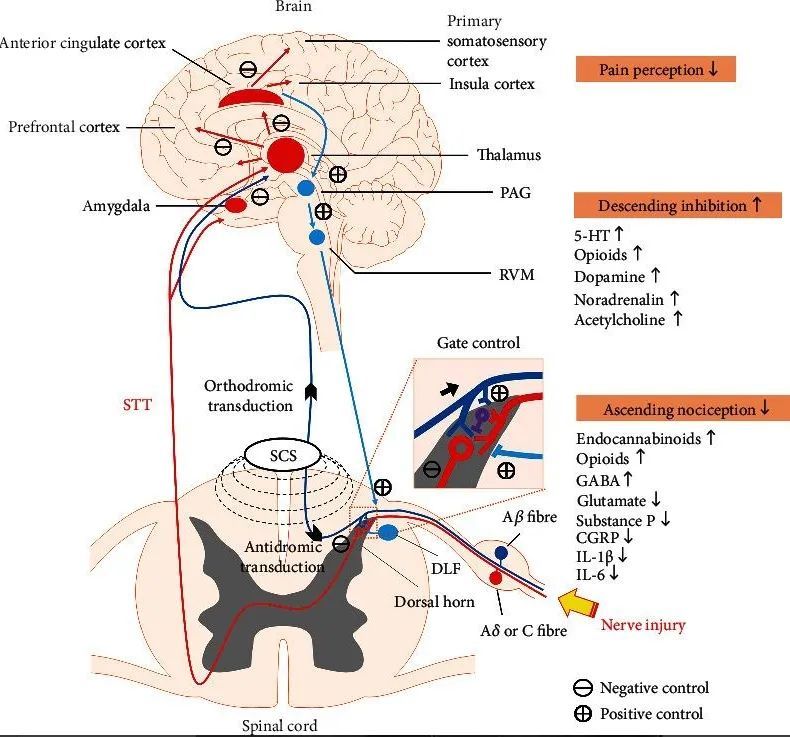
图3:脊髓电刺激作用机制示意图
图4:脊髓电刺激系统电极导线示意图
5. 经皮神经毁损术
通过物理(如射频热凝)或化学(如注射无水乙醇)方法,选择性地破坏传递疼痛信号的神经(躯体神经如肋间神经,或内脏神经丛如腹腔神经丛),以达到长期镇痛的目的。这是一种有创操作,适用于癌痛患者,一般不用于良性疼痛。
6. 鞘内药物输注系统植入术(IDDS)
将一个药物输注泵和导管植入体内,直接将微量镇痛药物(如吗啡、氢吗啡酮、齐考诺肽等)输送到脊髓周围的蛛网膜下腔(鞘内),直接作用于中枢神经系统,高效阻断疼痛信号。
- 优势: 镇痛效果强且稳定;药物用量极小(约为口服剂量的1/300),显著减少全身副作用;可远程调控剂量。
- 类型:全植入式: 泵和导管均在体内,感染风险低,不影响日常活动,但费用高,适合预期生存期较长(>3个月)者。
- 半植入式: 导管在体内,泵在体外,费用较低,但感染风险高,影响活动,适合预期生存期较短(<3个月)或经济受限者。
表3 全植入式鞘内输注系统和半植入式鞘内输注系统的比较
| 比较项目 | 全植入式鞘内输注系统 | 半植入式鞘内输注系统 |
| 植入部位 | 导管和药泵完全植入体内 | 导管植入体内,药泵则外置于体外 |
| 创伤性 | 创伤性相对较大 | 创伤性较小 |
| 调控方式 | 便捷(无线远程调控) | 不便(手动调整或更换) |
| 费用和维护 | 费用较高,维护频率低 | 费用较低,维护频率高 |
| 对日常生活的影响 | 不影响 | 受限(需携带体外泵) |
| 感染风险 | 低 | 较高 |
| 适合人群 | 预期生存期>3个月,需长期镇痛 | 预期生存期<3个月,经济受限或短期镇痛 |
IDDS的药物选择和剂量调整是关键,需要专业医生精细管理。
7. 放射性粒子植入术
将放射性粒子(如125I或103Pd)直接植入肿瘤病灶内部,通过持续释放低剂量射线杀伤肿瘤细胞,缩小肿瘤体积,从而缓解由肿瘤压迫或侵犯引起的疼痛,尤其适用于晚期肺癌骨转移等情况。其辐射范围局限,对周围正常组织损伤较小。
总结与展望
微创介入治疗为晚期肺癌伴难治性癌痛的患者提供了强有力的武器。从PCA、椎体强化、肿瘤消融到神经调控(SCS)、神经毁损、鞘内输注(IDDS)及放射性粒子植入,这些技术手段多样,各有侧重,能够显著缓解疼痛,改善患者生活质量,甚至可能延长生存期。
然而,选择最佳的治疗策略并非易事,需要临床医生根据患者的具体情况(疼痛性质、部位、程度、肿瘤状况、全身状况、经济承受能力、个人意愿等)进行个体化评估。通常,多模式镇痛(结合不同介入手段或药物)以及与放疗、化疗、靶向治疗、免疫治疗等抗肿瘤治疗的多学科协作(MDT)是实现最佳疗效的关键。同时,如何有效管理和克服长期治疗中可能出现的镇痛药物耐受或疗效减退,仍是未来研究需要关注的重点。
对于复杂的癌症治疗和疼痛管理决策,获取全面的信息至关重要。患者和家属可以利用如MedFind抗癌资讯这样的平台了解更多前沿信息,并通过海外靶向药代购服务获取所需的治疗药物。
参考文献:
[1] Papa L, Maguire L, Bender M, et al. Patient controlled analgesia for themanagement of acute pain in the emergency department: A systematic review[J]. Am J Emerg Med, 2022, 51: 228-238.
[2] Filippiadis DK, Tselikas L, Bazzocchi A, et al. Percutaneous Management of Cancer Pain[J]. Curr Oncol Rep, 2020, 22(5): 43.
[3] Cao DH, Gu WB, Zhao HY, et al. Advantages of unilateral percutaneous kyphoplasty for osteoporotic vertebral compression fractures-a systematic review and meta-analysis[J]. Arch Osteoporos, 2024, 19(1): 38.
[4] Zhao Q, Wang J, Fu YL, et al. Radiofrequency ablation for stage<iib non-small cell lung cancer: Opportunities, challenges, and the road ahead[J]. Thorac Cancer, 2023, 14(32): 3181-3190.
[5] Liu X, Zhan Y, Wang H, et al. Radiofrequency ablation versus microwave ablation for lung cancer/lung metastases: a meta-analysis[J]. ANZ J Surg, 2025, 95(1-2): 56-65.
[6] Cazzato RL, de Rubeis G, de Marini P, et al. Percutaneous microwave ablation of bone tumors: a systematic review[J]. Eur Radiol, 2021, 31(5): 3530-3541.
[7] Velez A, DeMaio A, Sterman D. Cryoablation and immunity in non-small cell lung cancer: a new era of cryo-immunotherapy[J]. Front Immunol, 2023, 14: 1203539.
[8] Kwak K, Yu B, Lewandowski RJ, Kim DH. Recent progress in cryoablation cancer therapy and nanoparticles mediated cryoablation[J]. Theranostics, 2022, 12(5): 2175-2204.
[9] Bachu VS, Kedda J, Suk I, Green JJ, Tyler B. High-Intensity Focused Ultrasound: A Review of Mechanisms and Clinical Applications[J]. Ann Biomed Eng, 2021, 49(9): 1975-1991.
[10] Hagedorn JM, Pittelkow TP, Hunt CL, et al. Current Perspectives on Spinal Cord Stimulation for the Treatment of Cancer Pain[J]. J Pain Res, 2020, 13: 3295-3305.
[11] Sheldon BL, Bao J, Khazen O, et al. Spinal Cord Stimulation as Treatment for Cancer and Chemotherapy-Induced Pain[J]. Front Pain Res (Lausanne), 2021, 2: 699993.
[12] Ontario Health. Intrathecal Drug Delivery Systems for Cancer Pain: A Health Technology Assessment