对于大多数微卫星稳定(MSS)的直肠癌患者而言,单一免疫检查点抑制剂(ICIs)的治疗效果往往不尽如人意。然而,放射治疗被认为能够增强肿瘤的免疫原性,有望通过调节肿瘤免疫微环境,使这些对免疫治疗不敏感的MSS直肠癌对免疫疗法产生响应,从而为联合免疫治疗提供理想平台。近年来,抗PD-1单药治疗与新辅助方案的结合已在直肠癌中展现出提升完全缓解率的潜力,但CTLA-4抑制剂能否带来额外的治疗益处,一直是临床研究关注的焦点。
研究背景:免疫治疗在直肠癌中的潜力
免疫检查点抑制剂在多种实体瘤中已证实其显著疗效,尤其在具有错配修复缺陷(dMMR)或微卫星不稳定性高(MSI-H)的肿瘤中表现突出。然而,对于占多数的MSS直肠癌,其对单一ICI治疗的耐药性是亟待解决的难题。放疗通过诱导肿瘤细胞死亡、释放肿瘤抗原,并改变肿瘤微环境,可能将“冷肿瘤”转化为“热肿瘤”,从而增强免疫治疗的效果。前期研究表明,CTLA-4抗体能有效清除调节性T细胞,增强T细胞的原始激活,而PD-1抗体则能减少T细胞耗竭。理论上,两者联合或序贯使用,有望协同激活更强大的抗肿瘤免疫反应。

临床试验设计:双免疫抑制联合新辅助放化疗
为了探究双重免疫检查点抑制剂联合新辅助放化疗(CRT)在直肠癌治疗中的安全性和可行性,一项多中心、随机、开放标签的II期临床试验应运而生。该研究共纳入80例局部晚期直肠癌患者,并将其随机分为两组:一组接受传统CRT治疗,另一组则在CRT基础上联合双重免疫检查点抑制剂。联合治疗方案包括CTLA-4抑制剂伊匹单抗(ipilimumab)(1 mg/kg,第7天静脉注射)和PD-1抑制剂纳武利尤单抗(nivolumab)(3 mg/kg,每2周一次,共3次静脉注射),同时配合口服卡培他滨(capecitabine)和50 Gy分次放疗。所有患者在CRT完成后10至12周内进行手术切除。主要观察终点是合并双重免疫检查点抑制剂后的手术安全性,包括手术并发症发生率及再手术率。次要观察终点则聚焦于临床及病理学治疗反应率,通过Dworak肿瘤回归评分和磁共振肿瘤回归评分(mrTRG)进行评估。
安全性评估:双免疫联合方案可行性高
研究结果显示,两组患者的基线特征均衡,男性占61%,中位年龄60岁。所有患者均顺利完成预定的新辅助CRT。在联合治疗组中,伊匹单抗的剂量完成率为100%,而纳武利尤单抗的完成率依次为98%、92%和80%。手术完成率为86%。值得注意的是,两组在手术并发症发生率(均为77%)及再手术率(CRT组8%,联合组7%)方面均无显著差异(P>0.99),这表明双免疫抑制联合方案在手术安全性方面是可行的。90天内死亡率极低,联合组仅出现1例非免疫相关死亡。
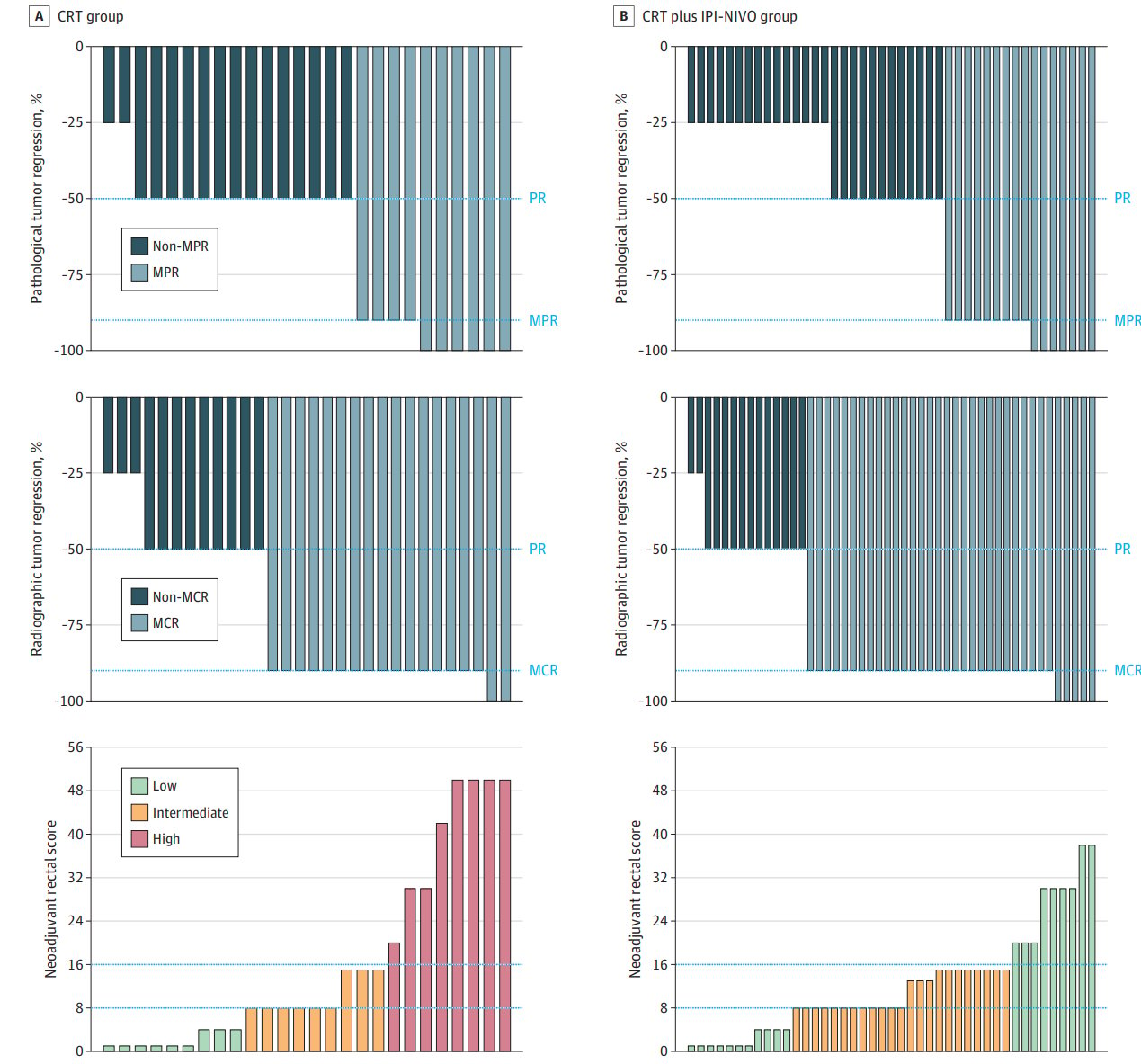
图:临床与病理缓解及新辅助直肠评分
在免疫相关不良事件方面,联合组Ⅲ级及以上不良事件发生率为30%,其中6%直接归因于免疫治疗,主要表现为肝炎、肌炎和腹泻,导致部分患者停药。尽管所有患者均经历至少1次不良事件,但两组间无显著差异。这提示短程免疫治疗方案有助于降低免疫毒性风险。
疗效分析:病理完全缓解率未显著提升
尽管安全性良好,但在疗效方面,病理完全缓解(pCR)率在CRT组为30%,联合组为22%,差异无统计学意义(P=0.44)。重大病理反应率(残余肿瘤≤10%)也未见显著差别。临床主要缓解率在联合组为71%,略高于CRT组的60%,但同样未达到统计学显著差异。分子检测结果显示,两组肿瘤均为MMR正常,KRAS、TP53等关键驱动基因突变频率相近,这进一步支持了疗效差异可能主要由治疗方案本身决定。
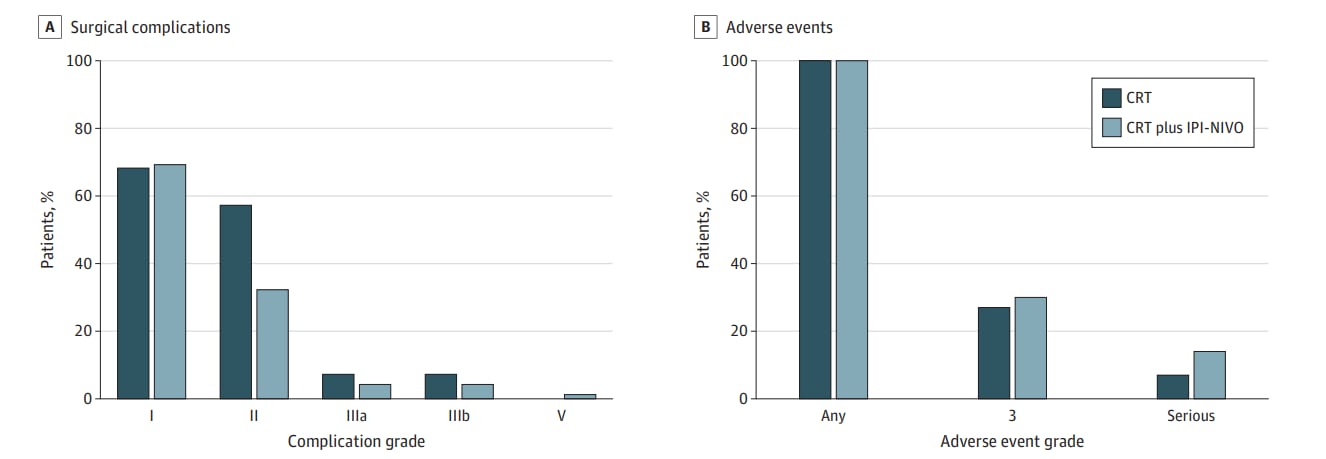
图:手术并发症与不良事件
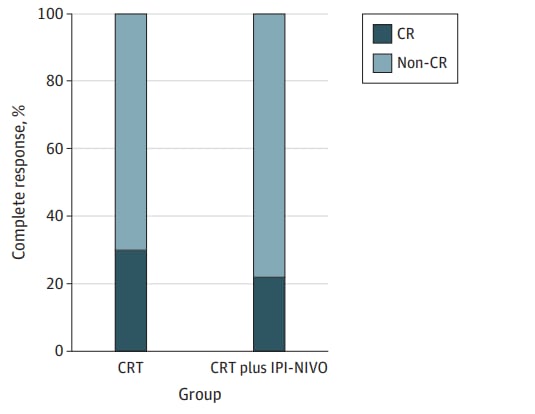
图:完全缓解率
研究结论与未来展望
这项II期临床试验首次证实,CTLA-4与PD-1双重免疫检查点抑制剂联合标准新辅助CRT治疗直肠癌患者具有良好的安全性,并未显著增加手术相关并发症或再手术风险。尽管免疫联合治疗未能显著提升病理完全缓解率,但双免疫抑制方案仍展示出一定的临床活性。研究人员指出,与总新辅助治疗(TNT)中加入化疗(如奥沙利铂)的方案相比,本研究中未加入此类药物可能是影响疗效的因素之一。未来,仍需进一步优化免疫治疗的剂量和时机,并结合生物标志物筛选,以精准识别最可能从免疫治疗中获益的直肠癌患者。目前,多项随机试验正在积极探索不同免疫治疗与放化疗的组合策略,其结果将为直肠癌免疫治疗的发展提供重要依据。对于正在寻求前沿癌症治疗方案,包括海外靶向药代购服务的患者,可以访问MedFind的购药服务页面,获取更多药物信息和支持。





