胰腺癌,尤其是胰腺导管腺癌(PDAC),因其高度侵袭性和早期转移的特性,一直是癌症治疗领域的巨大挑战。肿瘤细胞如何克服不同器官微环境的阻碍,成功在远处定植并生长,是理解和治疗癌症转移的关键。长期以来,关于PDAC转移的精确机制研究相对缺乏,但近期一项发表在《Nature》杂志上的突破性研究,为我们揭示了这一复杂过程中的一个关键驱动因素。
PCSK9:胰腺癌转移器官选择的关键调控因子
加州大学旧金山分校Rushika M. Perera教授团队的最新研究发现,一种名为PCSK9的蛋白质在决定PDAC细胞是优先转移到肝脏还是肺部方面扮演着核心角色。这项研究通过整合人类PDAC细胞系的转移数据、小鼠体内转移模型以及基因表达相关性分析,明确指出PCSK9的表达水平可以预测肿瘤细胞在肝脏和肺部的转移后定植能力。
研究表明,低水平PCSK9表达的PDAC细胞更倾向于在富含低密度脂蛋白(LDL)的肝组织中定植。这是因为低PCSK9水平使得肝细胞能更有效地摄取LDL-胆固醇,进而激活溶酶体上的mTORC1信号通路,促进肿瘤生长。同时,这些细胞还能通过转化为信号氧甾醇24(S)-羟基胆固醇,重编程微环境,促使邻近肝细胞释放营养物质,形成有利于肿瘤生长的循环。
相反,高水平PCSK9表达的PDAC细胞则更倾向于肺部转移。这些细胞依赖于远端胆固醇合成途径的转录上调,产生具有保护作用的代谢产物,从而抵抗铁死亡(一种程序性细胞死亡)。研究人员通过实验证实,增加PCSK9的量可以将嗜肝细胞重定向到肺部,而敲除PCSK9则能将嗜肺细胞转移到肝脏,这有力地证明了PCSK9是决定PDAC细胞次级器官部位偏好的必要且充分条件。

深入解析:PDAC细胞的器官偏好性与PCSK9的关联
1. PDAC细胞的不同器官偏好
研究团队利用高通量体内转移筛选技术,揭示了胰腺导管腺癌(PDAC)细胞存在显著的器官特异性转移模式。通过分析PDAC细胞系在肝脏、肺部、肾脏、大脑和骨骼等五个转移靶器官的定植倾向,研究人员将PDAC分为两个主要亚型:一类强烈偏好肝脏转移(C1-Liver亚型),另一类则更倾向于转移至肺部等其他器官(C2-Lung亚型)。这种差异不仅源于肿瘤细胞本身的遗传背景,还与特定的调控因素密切相关。
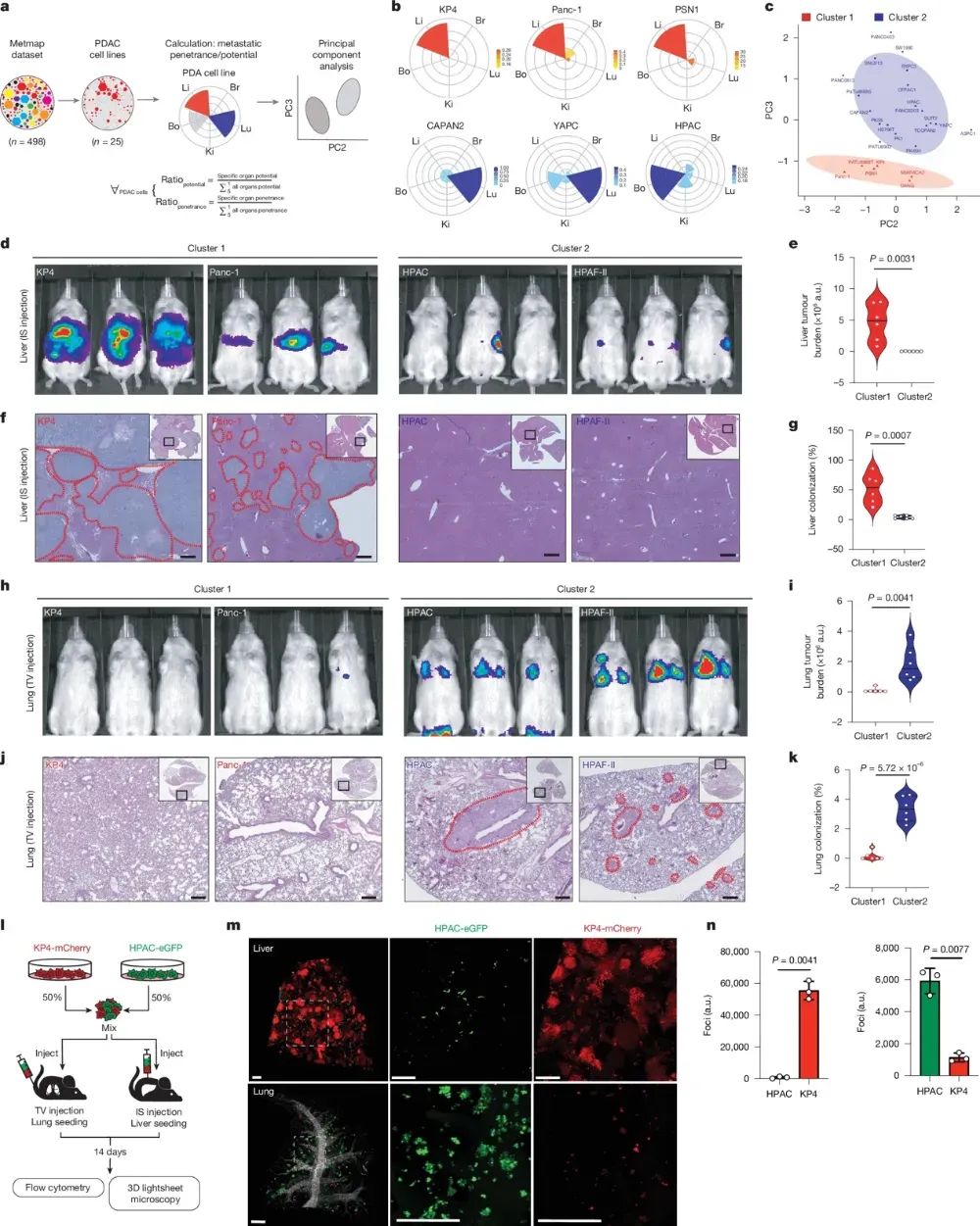
图1 PDAC细胞的不同器官偏好
2. PCSK9水平与器官偏好紧密相关
进一步的分析发现,PDAC细胞的器官特异性转移差异与PCSK9的表达水平密切相关。C2-Lung亚型细胞高表达PCSK9,从而抑制低密度脂蛋白受体(LDLR)的表达和胆固醇代谢;而C1-Liver亚型细胞则PCSK9表达较低,LDLR水平较高。临床样本分析也证实了这一发现:PCSK9低、LDLR高的肿瘤更易转移至肝脏,而PCSK9高、LDLR低的肿瘤则倾向于肺部转移。这一突破性发现为理解PDAC亚型特异性转移的分子机制提供了重要线索,也为基于PCSK9/LDLR代谢通路的肿瘤转移干预策略开发奠定了基础。
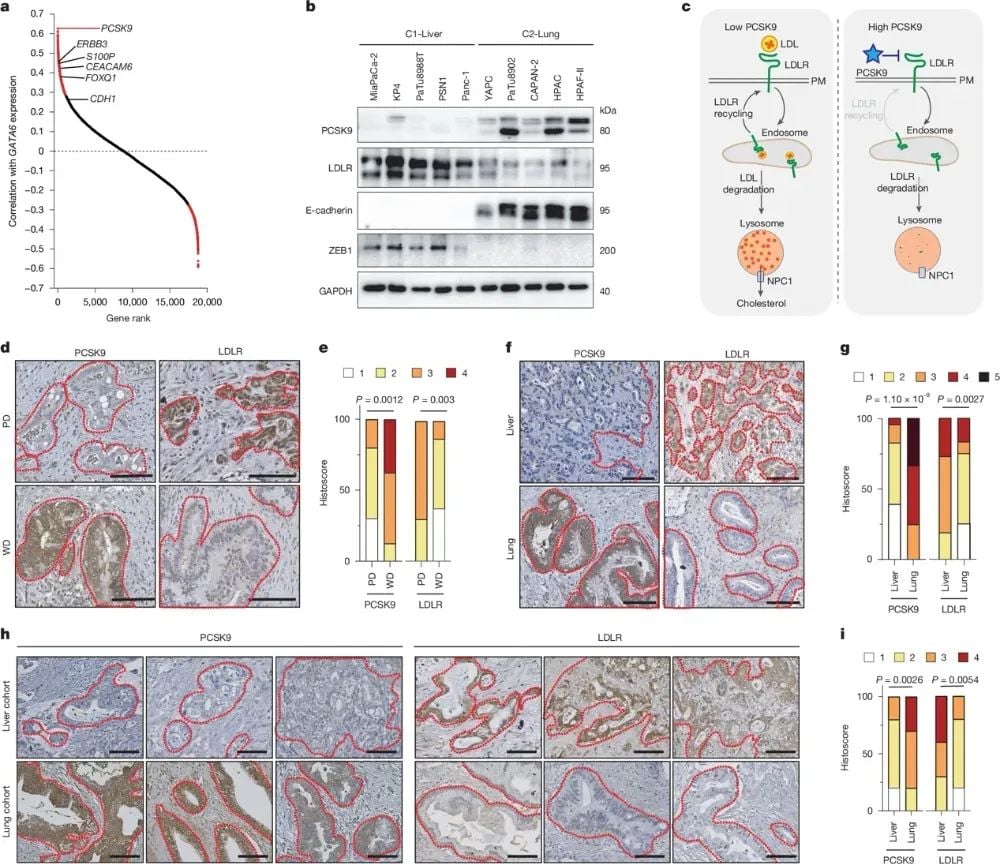
图2 PCSK9水平与器官偏好相关
3. 不同的胆固醇代谢指导转移器官偏好
研究深入探讨了胆固醇代谢在决定PDAC转移器官偏好中的作用。C1-Liver亚型细胞对LDL的摄取更为依赖,在脂蛋白缺乏的培养基中增殖受到抑制;而C2-Lung细胞则不受影响,它们更倾向于激活内源性胆固醇合成通路。这是因为C2-Lung细胞高表达调控胆固醇合成的关键转录因子SREBP2,导致下游合成酶表达增高,从而弥补了PCSK9抑制LDLR所致的LDL摄取下降。通过操纵PCSK9和LDLR的表达,可以显著改变肿瘤细胞在肝脏和肺部的生长能力,进一步证实了PCSK9调控的胆固醇代谢重编程是决定PDAC细胞器官特异性转移的关键机制。
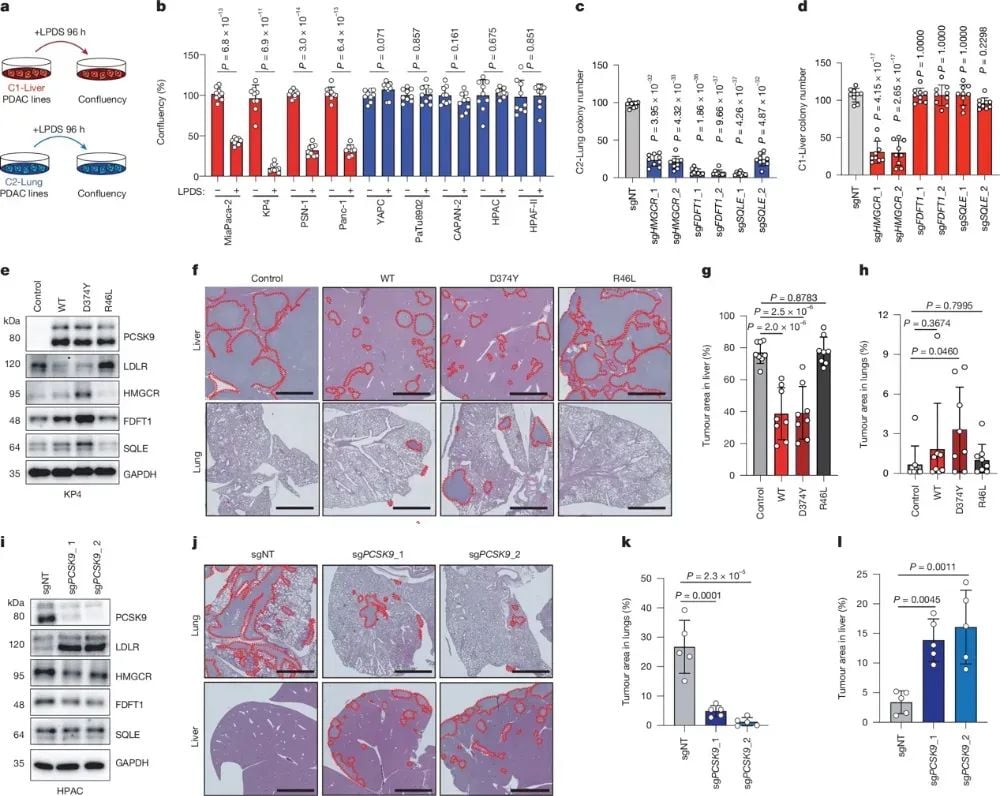
图3 不同的胆固醇代谢指导转移器官偏好
4. 肝细胞利用胆固醇激活mTORC1并调节微环境
对于C1-Liver亚型细胞,高内吞LDL-胆固醇导致溶酶体内大量胆固醇积累,进而激活mTORC1信号通路,促进肿瘤细胞增殖和存活。同时,这些细胞还上调表达特异性胆固醇羟化酶CYP46A1,合成24-羟胆固醇(24-HC)。24-HC能够通过LXR转录因子激活旁边肝细胞中胆固醇外排基因的表达,促使肝细胞向肿瘤细胞释放LDL-胆固醇。这种肿瘤细胞与肝细胞之间的化学信号反馈通路,形成了一个维持C1-Liver细胞肝转移生长的循环机制。相比之下,C2-Lung细胞由于PCSK9高表达而无法有效吸收LDL-胆固醇,因此难以通过这种途径调节肝微环境,从而更难在肝脏生长。
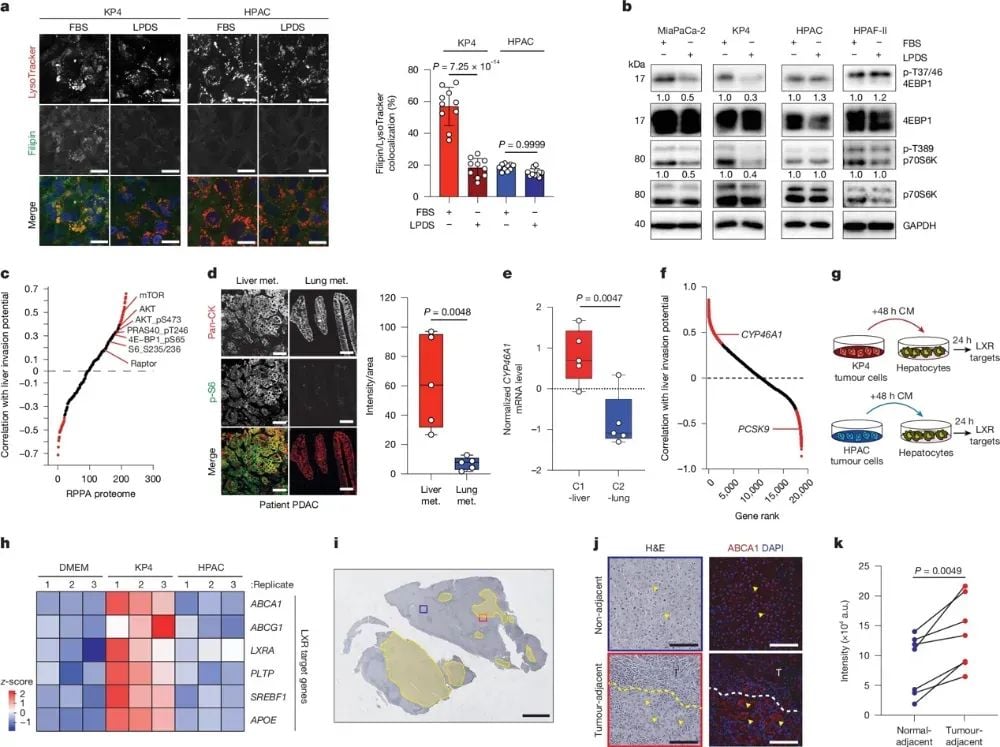
图4 肝细胞利用胆固醇激活mTORC1并调节微环境
5. 嗜肺PDAC细胞产生具有抗铁死亡特性的固醇中间体
高PCSK9水平导致7-脱氢胆固醇(7-DHC)和7-脱氢地塞米酮(7-DHD)等胆固醇合成中间体的积累。这些中间体具有抑制铁死亡的性质,能有效保护肿瘤细胞免受氧化应激伤害。相比之下,低PCSK9表达的C1-Liver细胞不依赖这种保护机制,更易受到铁死亡的诱导。实验进一步证明,C2-Lung细胞株对GPX4抑制剂RSL3和ML210的耐受性更强,而敲除PCSK9或阻断7-DHC、7-DHD合成能够降低其耐药性。同时,预处理7-DHC或7-DHD可以增强原本肝脏定植倾向的KPC1细胞在肺部的生长能力。这表明,PCSK9调控的内源性胆固醇代谢重编程不仅影响肿瘤细胞对LDL-胆固醇的依赖程度,进而决定肝脏和肺部的转移倾向,还通过产生抗铁死亡的中间体来保护C2-Lung细胞免受氧化应激伤害,从而促进其在肺部的定植和生长。
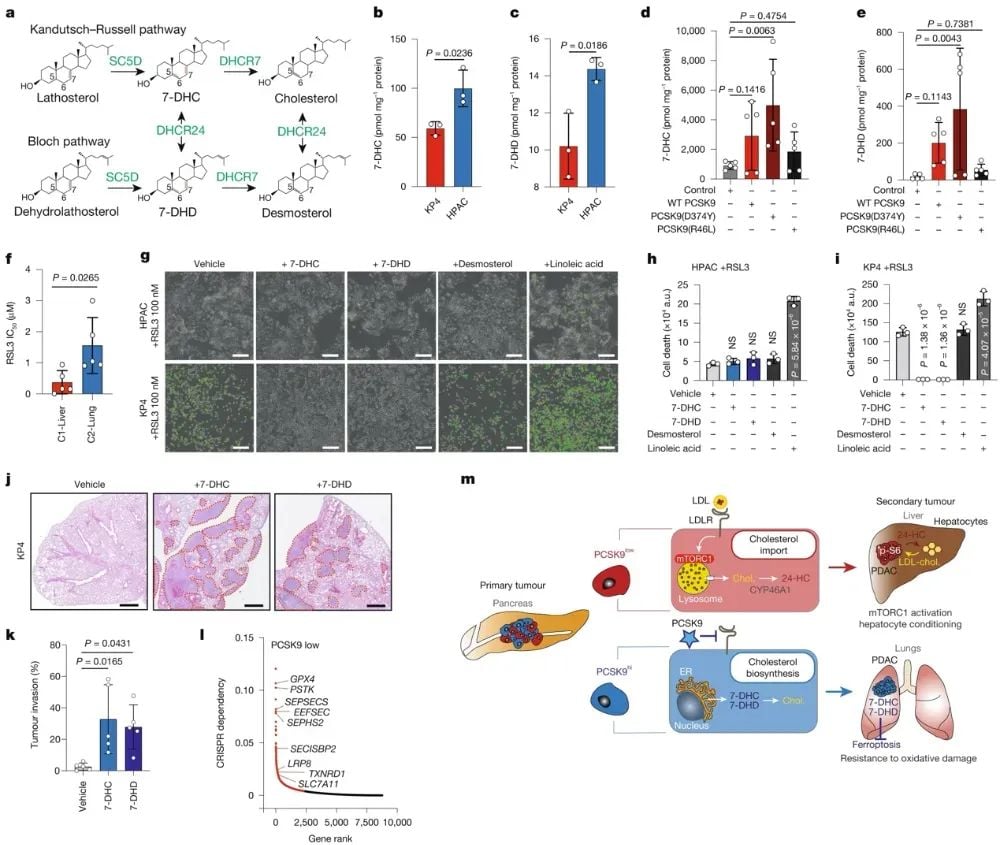
图5嗜肺PDAC细胞产生具有抗铁死亡特性的固醇中间体
结论与展望:靶向PCSK9的治疗潜力
这项研究深入揭示了胰腺癌细胞如何利用胆固醇代谢的可塑性,适应不同器官的微环境,从而实现选择性转移。PCSK9通过调节特定胆固醇中间体和衍生物的可用性,帮助肿瘤细胞克服肝脏和肺部生长相关的器官特异性挑战。由于甲羟戊酸-胆固醇通路的高度可塑性和可调性,其分支和输出在癌细胞生长各个方面的相对贡献尚不完全清楚。然而,这项研究明确指出,PDAC细胞对甲羟戊酸-胆固醇通路的不同利用,是其在肝脏和肺部代谢不同生态位定植的关键。这一发现不仅加深了我们对胰腺癌转移机制的理解,更具有潜在的临床应用价值,为开发新的靶向药和抗癌药,尤其是针对PCSK9或胆固醇代谢通路的治疗策略,提供了新的方向。
对于寻求胰腺癌靶向药、抗癌药或仿制药的患者,了解最新的研究进展至关重要。MedFind作为专业的海外靶向药代购平台,不仅提供便捷的药品代购服务,更有AI问诊及丰富的抗癌资讯,助力患者获取全球优质医疗资源。





