横纹肌肉瘤(RMS)是儿童时期常见的恶性肿瘤,其中肺泡型横纹肌肉瘤(ARMS)因其高度侵袭性、易转移和预后差而构成严峻挑战。尽管ARMS的基因突变数量相对较少,但其特有的染色体易位产生了致癌性的PAX3/7-FOXO1融合蛋白,目前针对这一融合蛋白尚缺乏有效的小分子抑制剂。因此,深入理解PAX融合蛋白如何驱动ARMS的发生发展,并寻找新的治疗靶点,对于改善患者预后至关重要。
近期,一项发表在国际知名期刊Cell上的研究,由纽约大学等机构的研究人员共同完成,为ARMS的治疗带来了新的视角。该研究通过构建工程化的人类诱导多能干细胞(iPSC)来源的肌肉祖细胞模型,深入解析了PAX3/7-FOXO1融合蛋白介导的基因组和表观基因组重编程事件,揭示了其如何重塑染色质结构、增强致癌基因表达,并鉴定出ARMS中异常的线粒体氧化磷酸化代谢特征及关键调控因子,为开发新的**靶向药**和治疗策略提供了理论基础。

PAX融合蛋白:ARMS发生的关键驱动力
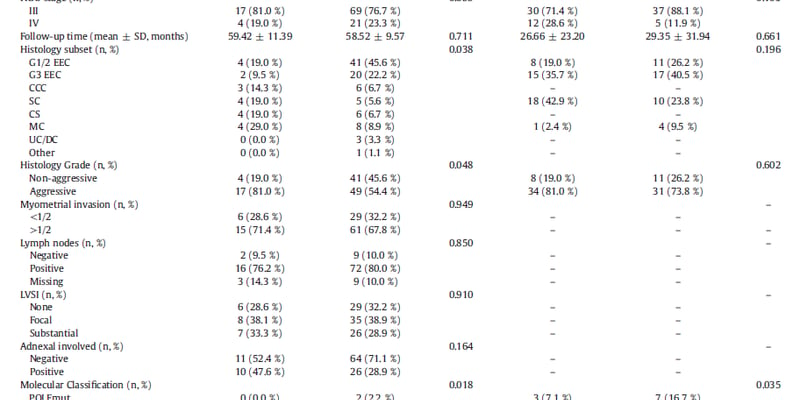
研究人员首先分析了PAX融合蛋白阳性的ARMS肿瘤样本和异种移植模型(O-PDX),发现它们的基因表达谱与表达PAX7的骨骼肌干细胞密切相关。基于此,他们成功构建了在iPSC中表达PAX3/7融合蛋白的ARMS细胞模型。实验证实,在骨骼肌干细胞中表达PAX3/7融合蛋白能够模拟ARMS肿瘤细胞的异常生长和增殖特性,特别是PAX3-FOXO1融合蛋白表现出更强的异常增殖能力。转录组分析进一步表明,表达PAX3/7融合蛋白的细胞其基因表达模式与正常的肌肉分化过程显著不同,而与RMS肿瘤的转录特征一致,验证了该模型在研究ARMS发病机制方面的有效性。

图1 构建表达PAX融合蛋白的肺泡型横纹肌瘤iPSC细胞模型
染色质重塑与致癌基因激活
通过CUT&RUN等技术,研究发现PAX融合蛋白能够结合基因组中的启动子、内含子和远端区域。尽管启动子结合位点相对较少,但在启动子区域的组蛋白修饰(H3K4me3)显著增加。更重要的是,PAX3/7融合蛋白的表达导致增强子和超级增强子(SE)数量显著增加,特别是PAX7融合蛋白,可占据高达90%的超级增强子区域。HiC和pCHiC技术分析显示,PAX7融合蛋白在加强染色质重塑和增强启动子与增强子相互作用方面发挥关键作用,从而显著增强靶基因的表达。
结合基因组结合和染色质相互作用数据,研究人员发现多个重要的癌基因,如MYCN、MET、JUN和FOXM1,被PAX3/7融合蛋白结合并激活。此外,融合蛋白还介导了关键肌肉调节因子MYOD1和MYOG特异性启动子和增强子相互作用,导致这些基因表达上调,这与RMS的特征一致。这表明PAX融合蛋白通过重塑染色质结构激活肌肉调节因子表达,使得细胞维持高度增殖和异常生长状态。

图2 肺泡型横纹肌瘤iPSC细胞模型基因组和表观基因组特征
研究进一步聚焦于MYCN基因位点,发现在表达PAX7融合蛋白的细胞中,MYCN启动子下游存在一个超级增强子,PAX7-FOXO1通过长距离相互作用增加MYCN表达。MYCN在ARMS中的高表达及其在肿瘤生存和进展中的重要作用得到了证实。通过CRISPRi沉默该增强子,可以降低MYCN表达,削弱ARMS细胞的增殖能力和体内成瘤性,进一步验证了PAX融合蛋白通过染色质重塑上调MYCN表达促进肿瘤进展的机制。

图3 鉴定MYCN下游的远端超级增强子增加MYCN表达促进肿瘤进展
线粒体代谢异常:肿瘤生长的能量来源
为了寻找ARMS中潜在的**靶向药**靶点,研究人员分析发现,PAX融合蛋白阳性细胞和iPSC模型中线粒体相关基因表达失调,包括线粒体代谢的主要调节因子PPARGC1A及氧化磷酸化(OXPHOS)调控因子表达上调。PAX3-FOXO1能与PPARGC1A增强子结合促进其表达。融合蛋白阳性细胞表现出更高的线粒体膜电位、质量和数量,以及基础和最大氧气消耗速率增加,表明其线粒体形态和功能增强。这揭示了PAX融合蛋白可通过PPARGC1A促进肿瘤细胞的线粒体氧化磷酸化,为肿瘤快速生长提供能量。

图4 ARMS中的线粒体变化及代谢特征分析
研究还发现,线粒体转运tRNA在ARMS患者和iPSC模型中表达上调,并且tRNA甲基转移酶TRMT5是PAX3/7融合蛋白共同的转录靶点。沉默TRMT5表达可显著抑制癌细胞的克隆形成能力,延缓小鼠模型中的肿瘤生长,并导致线粒体功能受损。这表明PAX融合蛋白通过激活TRMT5增强线粒体氧化磷酸化,从而支持ARMS肿瘤的生长和维持。

图5 TRMT5在ARMS发展中的关键作用
此外,研究发现ARMS细胞优先表达线粒体编码基因,并对特定亮氨酸密码子有偏好。亮氨酸缺乏显著降低了细胞的克隆形成和增殖能力,体内实验也证实限制亮氨酸摄入可减轻肿瘤负担、改善生存。这说明PAX融合蛋白阳性ARMS肿瘤细胞对亮氨酸的敏感性增加,提示亮氨酸代谢可能是一个潜在的治疗干预点。

图6 限制亮氨酸摄入可延缓肺泡状横纹肌肉瘤肿瘤进展
联合疗法探索:roblitinib与tigecycline的潜力
成纤维细胞生长因子受体4(FGFR4)也被鉴定为PAX融合蛋白的关键靶标,并在RMS中高表达。染色质相互作用分析显示融合蛋白可增强FGFR4表达。基于这些发现,研究人员尝试联合使用选择性FGFR4抑制剂roblitinib(ROB)和线粒体翻译抑制剂tigecycline(TIG)治疗ARMS。体外实验显示,联合用药对ARMS肿瘤细胞的增殖和自我更新能力有显著抑制作用。
体内实验在携带不同ARMS肿瘤的O-PDX小鼠模型中进行。结果令人鼓舞:对于PAX3/7融合阴性的模型,联合治疗无效;但对于PAX3/7融合阳性的模型,TIG+ROB联合治疗显著提高了小鼠的生存率。例如,在SJRHB013757_X2(PAX7-FOXO1)模型中,联合治疗组的平均生存期远长于单药组。

图7 ROB和TIG联合使用在小鼠RMS O-PDX模型疗效
结论与展望
这项研究通过构建创新的iPSC模型,深入揭示了PAX3/7-FOXO1融合蛋白在肺泡型横纹肌肉瘤中重塑染色质、激活关键致癌基因(如MYCN, FGFR4)和线粒体代谢相关基因(如PPARGC1A, TRMT5)的复杂机制。这些机制共同增强了线粒体氧化磷酸化,为肿瘤生长提供了动力。研究不仅确定了MYCN、FGFR4、PPARGC1A、TRMT5和亮氨酸代谢等潜在的治疗靶点,还通过动物模型验证了联合使用FGFR4抑制剂roblitinib和线粒体翻译抑制剂tigecycline在PAX融合阳性ARMS中的协同疗效,为高危肺泡型横纹肌肉瘤患者提供了新的潜在靶向治疗策略。
对于癌症患者而言,获取最新的靶向药或仿制药信息,以及了解海外购药途径至关重要。在面对复杂的癌症信息和治疗选择时,专业的AI问诊服务可以提供辅助参考。MedFind平台也提供丰富的药物信息和抗癌资讯,帮助患者和家属更好地了解疾病和治疗进展。