子宫内膜非典型增生(Atypical Hyperplasia, AH)或称子宫内膜样上皮内瘤变(Endometrioid Intraepithelial Neoplasia, EIN),是子宫内膜癌最常见的癌前病变。准确的病理诊断对于指导临床治疗、改善患者预后至关重要。然而,AH/EIN的形态学表现多样,易与某些良性病变混淆,给诊断带来挑战。本文将重点探讨AH/EIN的鉴别诊断要点以及生物标志物的应用价值。
AH/EIN的鉴别诊断要点
在病理诊断中,需将AH/EIN与以下几种情况仔细区分:
1. 与子宫内膜息肉的区分
子宫内膜息肉和AH/EIN都可能出现腺体拥挤、分支和囊状扩张。但子宫内膜息肉通常表现为局灶性改变,腺体结构虽可不规则,但拥挤程度相对较轻,腺体走向常与表面上皮平行。其间质通常是纤维性的,并可见扩张的厚壁血管。息肉中拥挤腺体的细胞学特征通常与背景非拥挤腺体相似。只有当拥挤腺体出现明显的细胞核增大、核复层化和极性丧失等非典型性改变时,才应考虑AH/EIN的诊断。
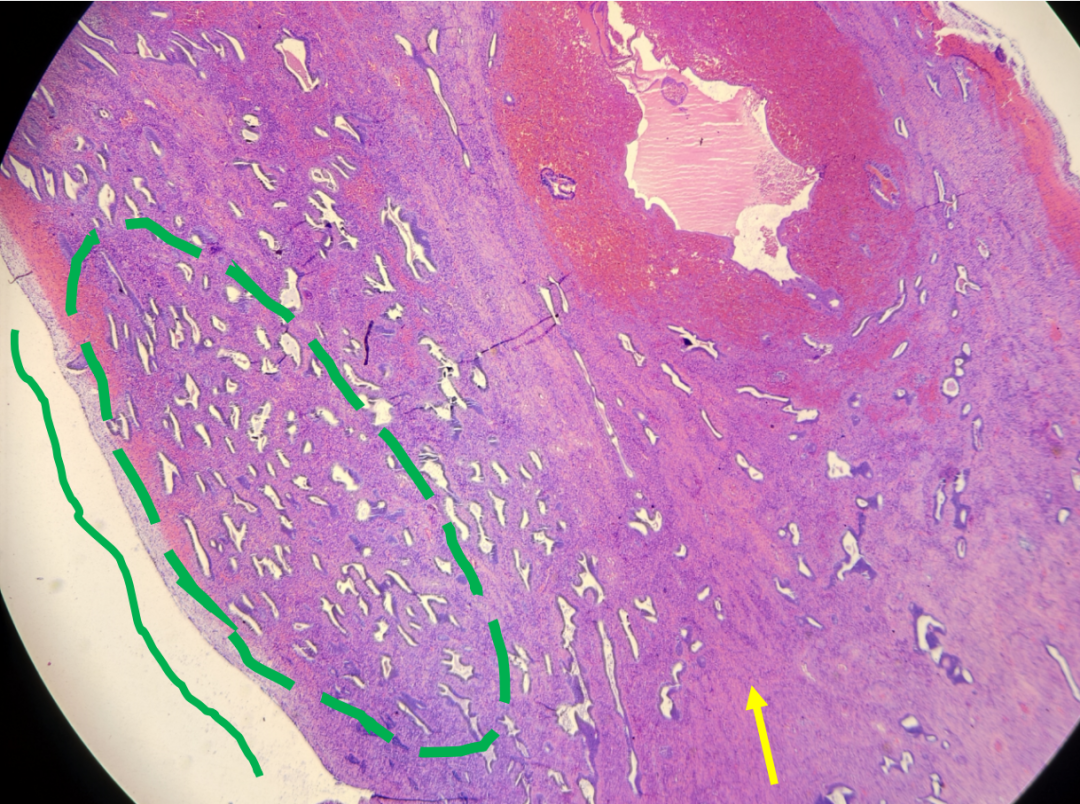
图示:子宫内膜息肉,腺体拥挤、分支、形态不规则,走向与表面平行(绿色虚线),伴纤维性间质(黄色箭头)。
图示:子宫内膜息肉中的厚壁血管簇(红色虚线)。
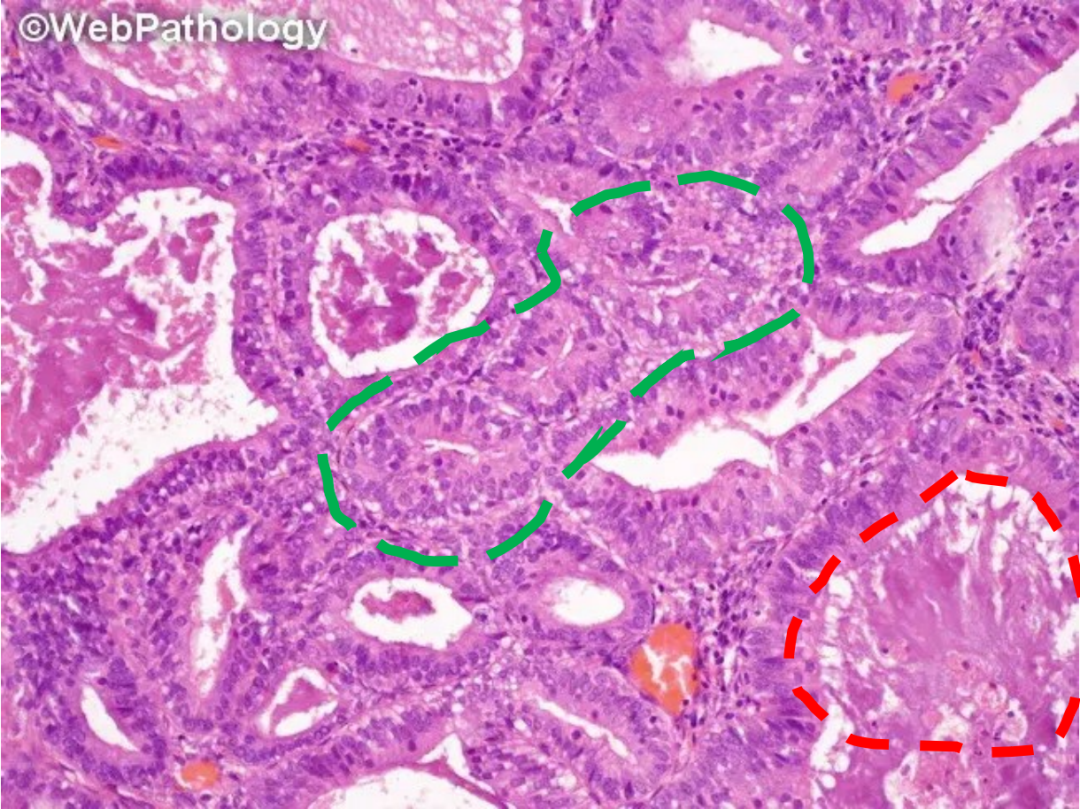
2. 与子宫内膜化生的区分
子宫内膜可发生多种类型的化生,如纤毛(输卵管)化生、嗜酸细胞性化生、鳞状化生等。这些化生灶可能出现在正常、增生或肿瘤性子宫内膜中,有时会使诊断复杂化。化生区域的细胞形态与背景子宫内膜不同,可能模仿肿瘤。评估时需注意化生的类型、分布范围,并比较化生区与非化生区腺体的细胞学和结构特征。单纯的化生通常不伴有腺体的显著拥挤。若在腺体拥挤的病灶中观察到明显的化生,且这些腺体与非拥挤腺体相比存在显著的细胞学和结构差异,则需考虑AH/EIN伴化生性改变的诊断。
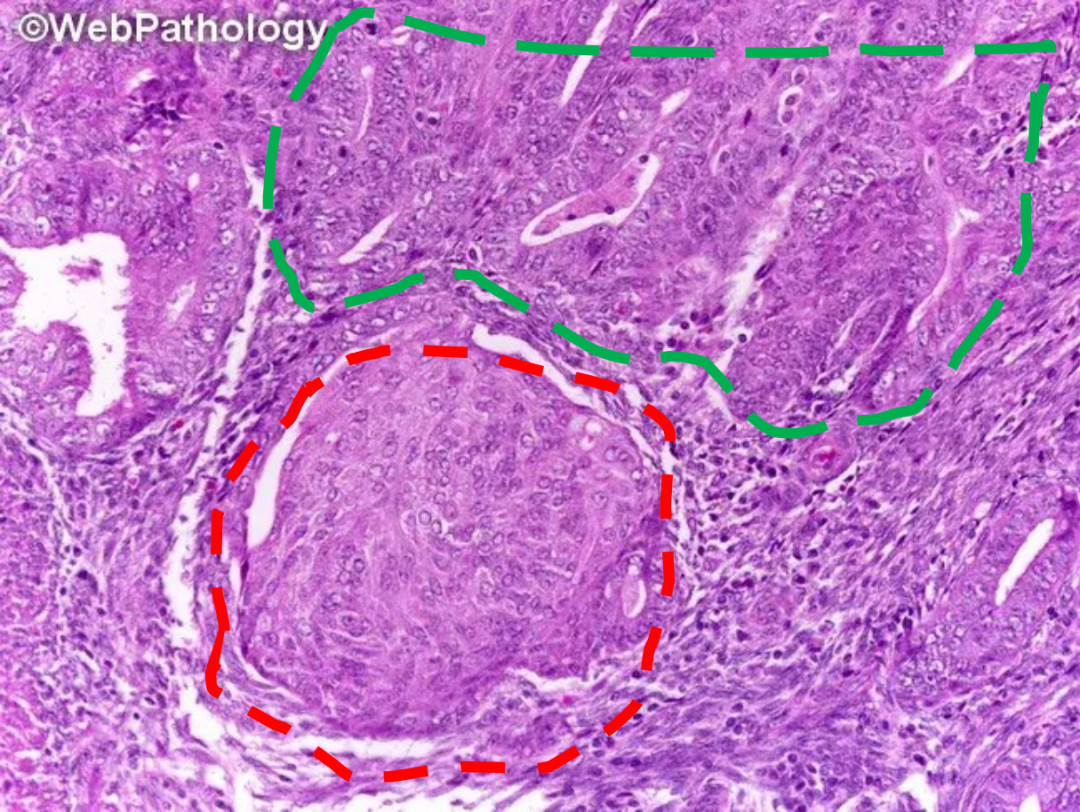
图示:子宫内膜非典型增生(绿色虚线:腺体密集拥挤,细胞核增大,极性紊乱)背景下的鳞状化生(红色虚线:桑葚状化生)。
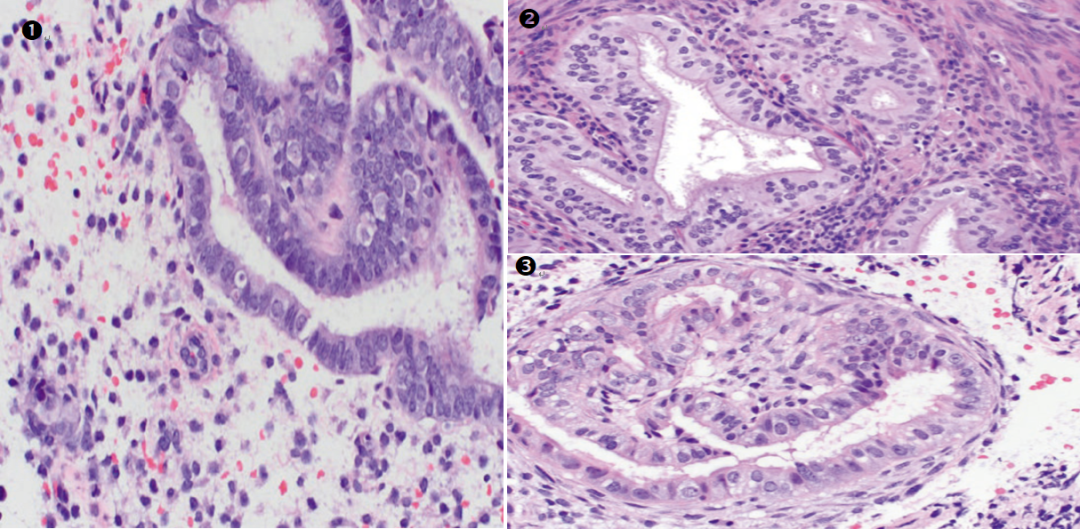
图示:①纤毛(输卵管)化生。②③灶状增生的腺体伴纤毛(输卵管)化生。评估此类病灶时,腺体结构的复杂性是主要依据。
图示:子宫内膜非典型增生背景下的输卵管化生,可见拥挤、结构复杂的腺体。
图示:高倍镜下,纤毛细胞(红色虚线)间散布透明细胞(绿色实线),细胞层次增多,极性紊乱。
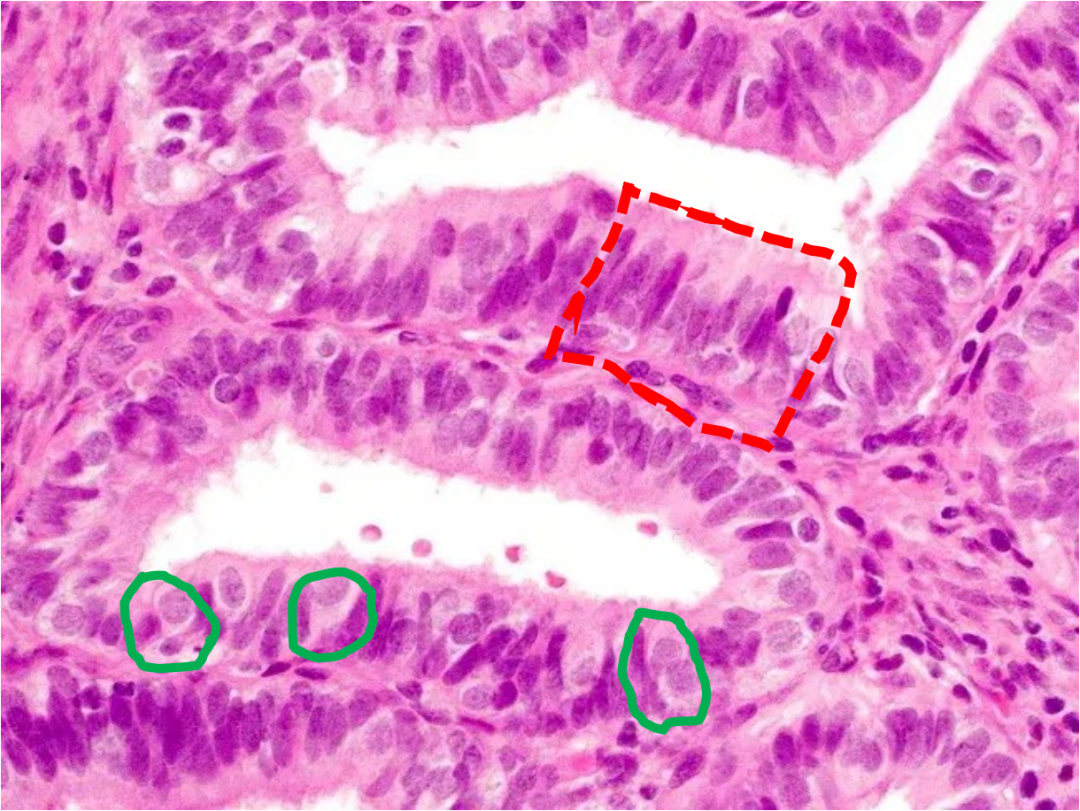
3. 与分泌性子宫内膜及分泌型AH/EIN的区分
AH/EIN有时可伴有分泌性改变,称为分泌型AH/EIN。其组织学上保留了经典AH/EIN的部分特征(如腺体排列杂乱、结构复杂),同时可见分泌期样改变(如胞质丰富透明、核下空泡等)。正常的分泌期子宫内膜虽然腺体也可拥挤、弯曲,甚至呈锯齿状,但腺体排列相对规则,细胞有极性。而分泌型AH/EIN的腺体拥挤和结构复杂程度通常更显著,排列更不规则。免疫组化Ki-67的表达有助于鉴别,分泌型AH/EIN的Ki-67指数通常明显高于背景分泌性内膜。
图示:伴有分泌改变的AH/EIN,腺体密集拥挤,排列不规则,可见核下空泡(绿色虚线)和管腔分泌物(红色虚线),但细胞层次增多、极性紊乱及核非典型性支持AH/EIN诊断。
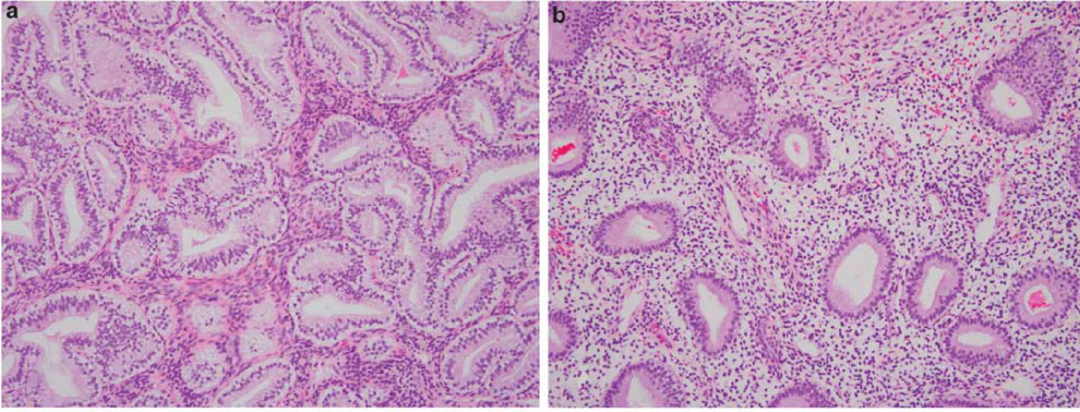
a:分泌型AH/EIN,腺体密集拥挤,细胞层次多,极性乱; b:背景分泌性子宫内膜,腺体稀疏,细胞单层,排列整齐。
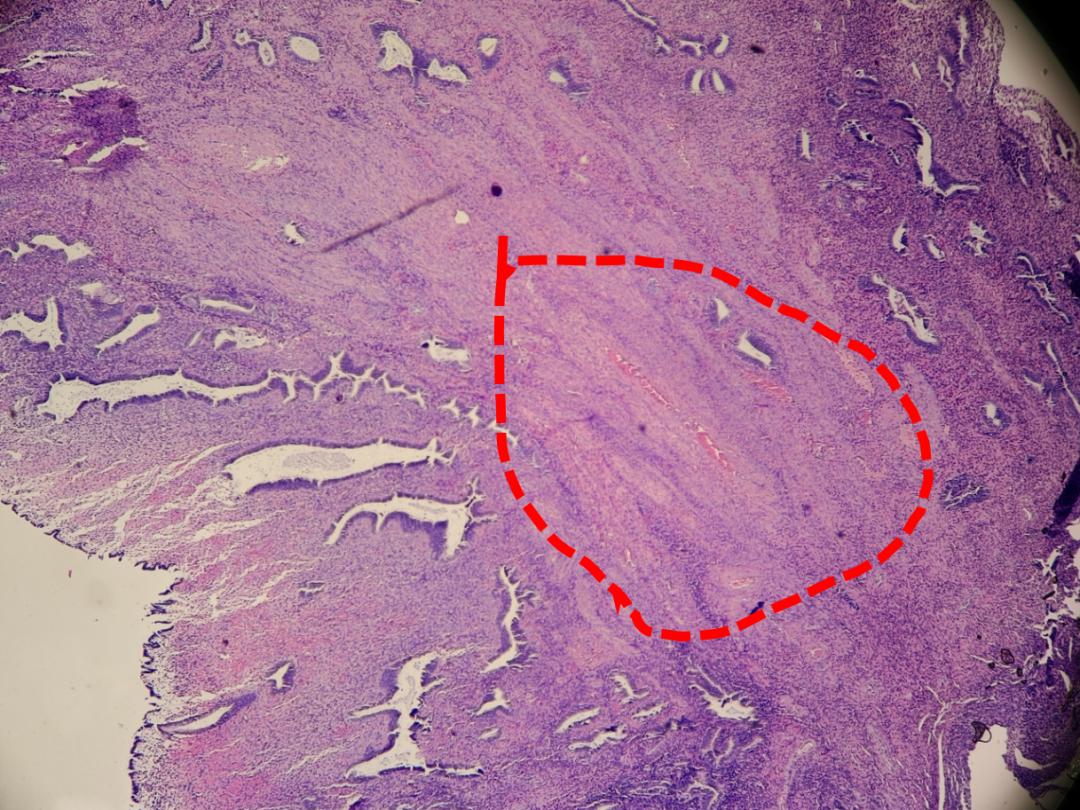
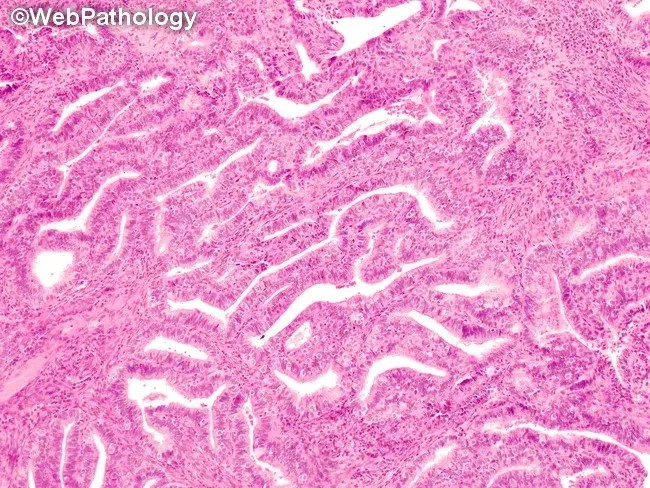
4. 与子宫内膜样癌的区分
这是鉴别诊断中最重要的一环。AH/EIN与高分化子宫内膜样癌的主要区别在于腺体结构的复杂程度和间质反应。
| AH/EIN | 子宫内膜样癌 |
| 腺体拥挤,但通常保持独立轮廓,缺乏真正的腺体融合、筛状结构或复杂的乳头状结构;
腺体之间仍可见正常的子宫内膜间质。 |
腺体结构更复杂,出现腺体融合(背靠背)、筛状结构、迷路状、绒毛管状结构,甚至实性区域;
正常的内膜间质消失,常被促纤维反应性间质替代。 |
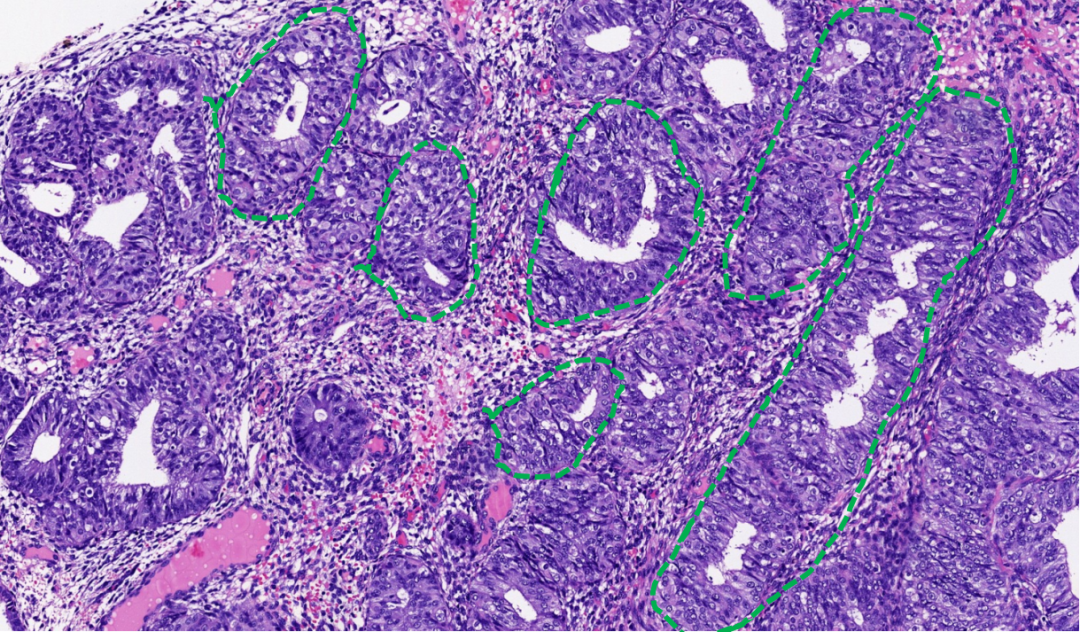
图示:AH/EIN,腺体拥挤但结构相对独立(绿色虚线),间质存在。
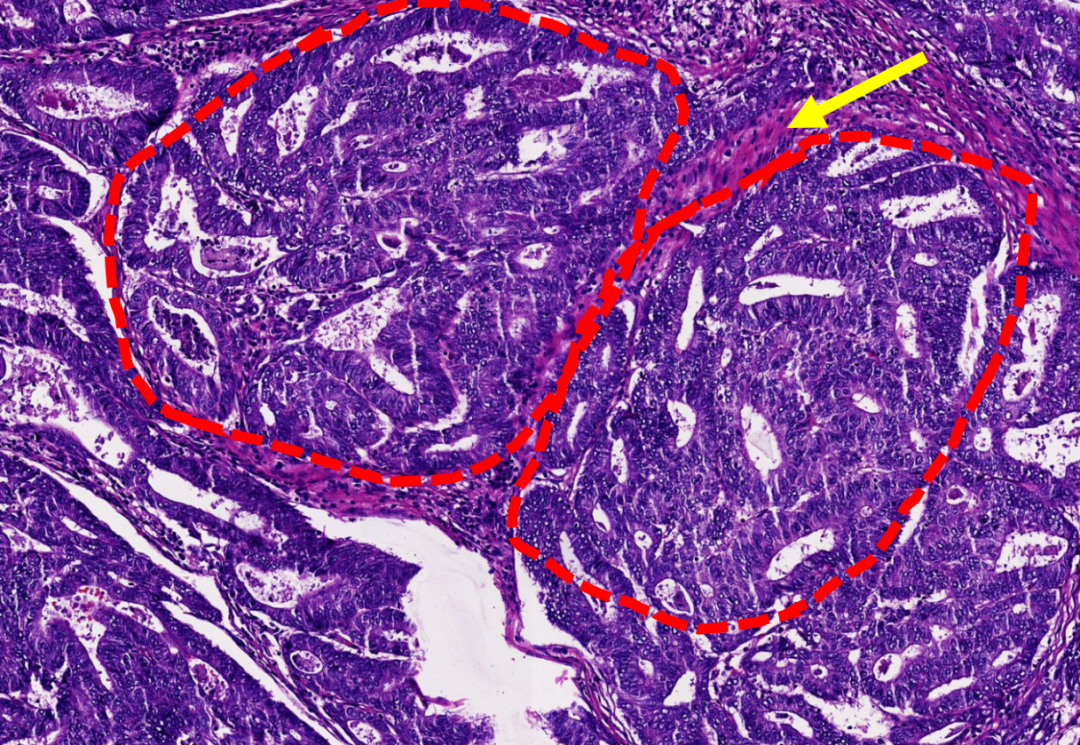
图示:子宫内膜样癌,腺体结构复杂,融合呈筛网状(红色虚线),间质纤维化(黄色箭头)。
AH/EIN诊断中生物标志物的应用进展
近年来,基于TCGA等研究成果,一系列生物标志物被应用于辅助AH/EIN的诊断,以提高准确性和客观性。通过比较正常子宫内膜与AH/EIN中这些标志物的表达模式,可以为诊断提供重要线索。
以下表格总结了常用生物标志物在正常子宫内膜中的表达模式及在AH/EIN中的异常判读标准:
| 生物标志物表达特征 | |||
| 标记物 | 正常模式 | AH/EIN中的异常模式 | AH/EIN中异常表达概率 |
| PAX2 | 强烈、均匀的细胞核染色。(注:正常内膜可有散在<5%腺体丢失,息肉中丢失可达10-20%) | • 较大病变:>5%腺体表达缺失(需与背景对照)。
• 小病变:>50%有细胞学改变的腺体表达缺失。 • 息肉背景下:需谨慎判读,结合形态和其他标志物。 |
70–80% |
| PTEN | 主要是细胞质染色。(注:正常内膜可有散在<5%腺体表达缺失) | • 较大病变:>5%腺体表达缺失(需与背景对照)。
• 小病变:>50%有细胞学改变的腺体表达缺失。 |
40–50% |
| β-catenin | 普遍的细胞膜染色,部分间期内膜可见弱核染。 | • 强烈的细胞核表达(弥漫或局灶,均匀或散在)。 | 约50% |
| ARID1A | 弥漫的细胞核染色。 | 细胞核染色缺失。 | 约10% |
| MMR蛋白 | 弥漫的细胞核染色。 | 细胞核染色缺失(错配修复缺陷)。 | <5% |
| p53 | 野生型模式:可变比例、可变强度的细胞核染色。 | 突变型模式:
• 过表达(>80%细胞核强阳性)。 • 完全缺失(零表达,需内对照)。 • 细胞质表达。 |
<3% (在AH/EIN中罕见突变型表达) |
重要提示:
- 目前研究推荐联合应用PAX2、PTEN和β-catenin三联标记物来提高AH/EIN诊断的准确性,据报道敏感性可达92.8%。加入ARID1A、MMR或p53等其他标志物并未显著提高敏感性。
- 桑葚状化生(Morular metaplasia)是与CTNNB1基因突变密切相关的形态学特征,常表现出异常的β-catenin核表达。在AH/EIN或子宫内膜样癌中看到桑葚状化生,是提示β-catenin通路异常的重要线索。
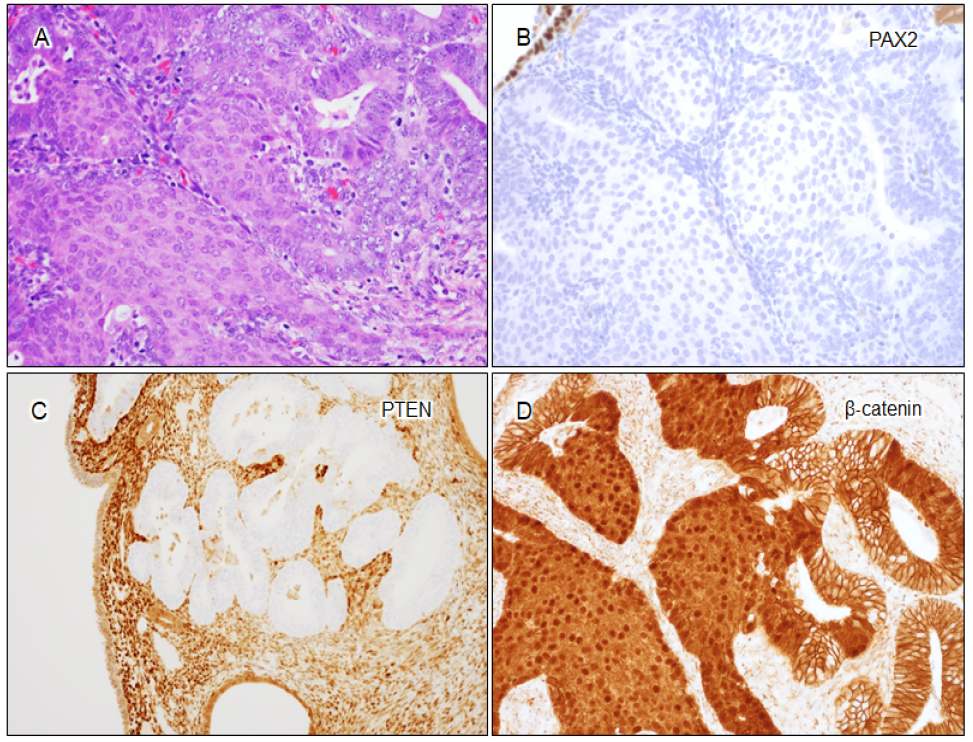
图示:AH/EIN病例中的桑葚状化生与生物标志物。(A)HE染色示桑葚状化生;(B)PAX2表达缺失;(C)PTEN表达缺失;(D)β-catenin核染色异常,桑葚状化生区域弥漫核阳性。
- 判读PAX2和PTEN缺失时需注意:正常内膜可有散在丢失,异常标准通常设为>5%腺体完全缺失。对于微小病灶,可采用>50%病变腺体表达缺失的标准。PTEN弱表达不应视为缺失。
- 在子宫内膜息肉背景下,PAX2可能出现异常表达(高达15%),此时判读PAX2缺失需结合形态学和其他标志物(如PTEN和β-catenin通常正常)。
回顾一个诊断困难的病例:子宫内膜息肉背景下,少量腺体略拥挤,细胞形态与背景略有差异。免疫组化显示PAX2表达丢失,PTEN弱表达。结合文献,尤其是在息肉背景下PAX2可能丢失,且PTEN弱表达应视为阳性,该病例倾向于不诊断为AH/EIN。然而,不同医院的会诊意见可能存在分歧,显示了诊断的复杂性。
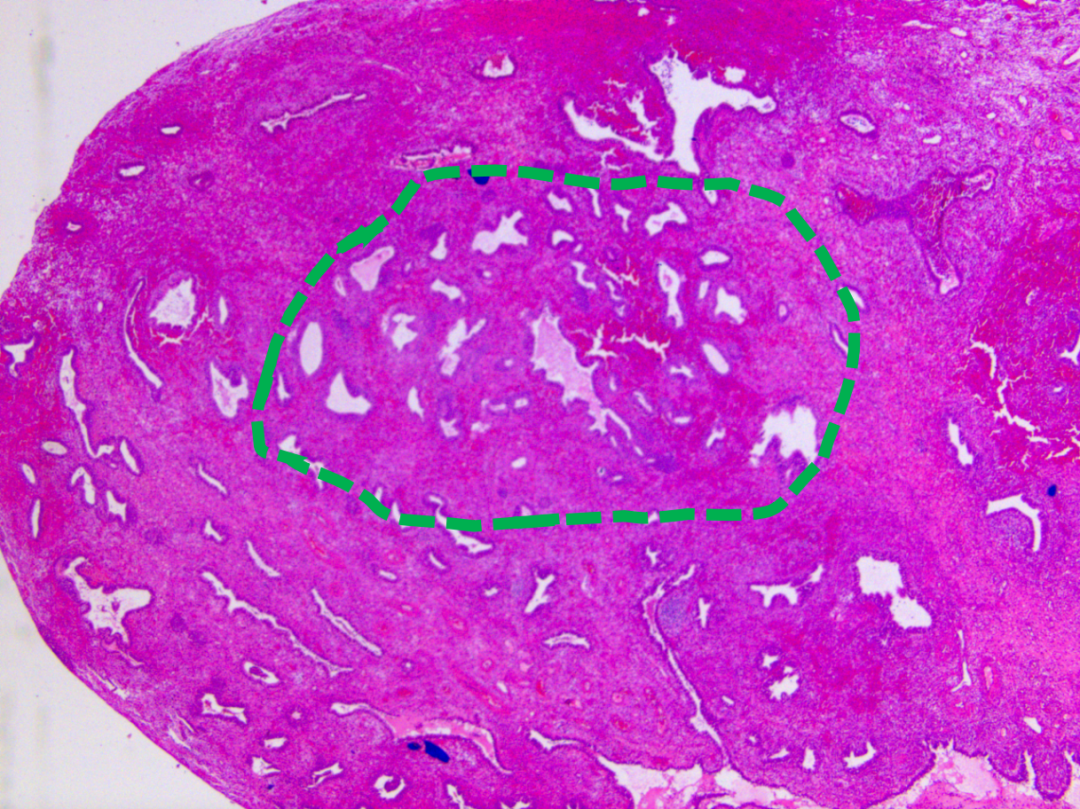
图示:低倍镜下局部腺体略显拥挤,形态不规则。
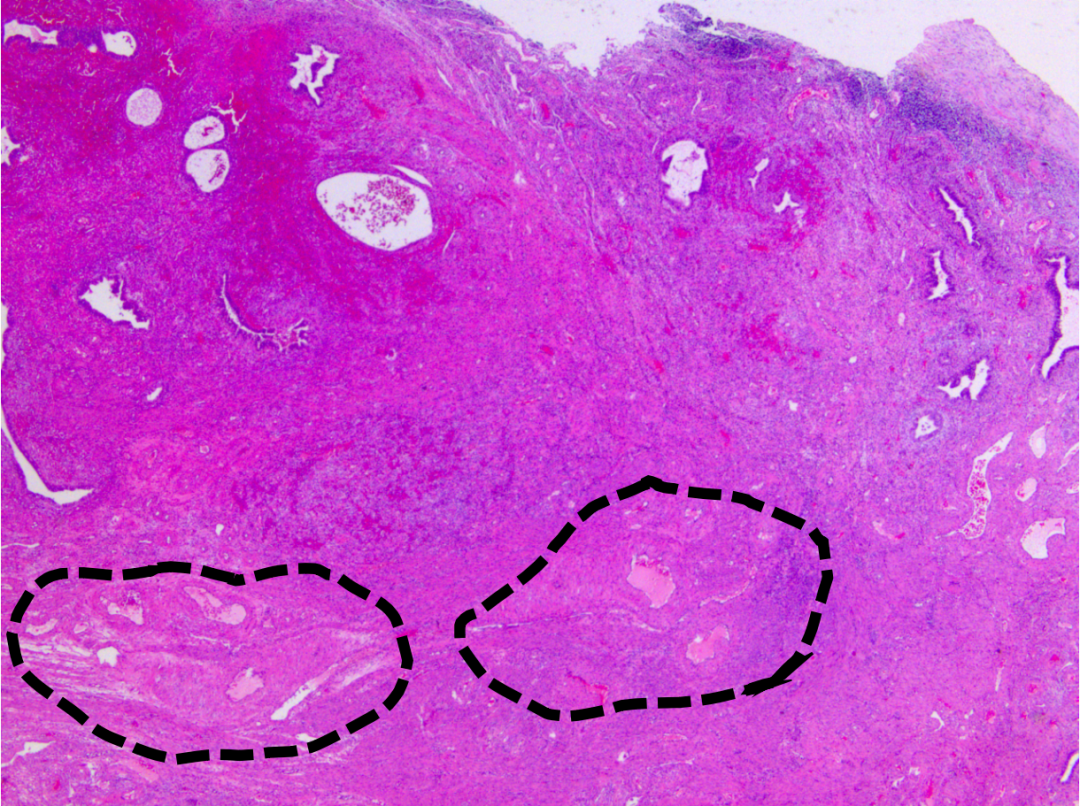
图示:间质纤维化,可见不规则厚壁血管(黑色虚线),符合子宫内膜息肉改变。
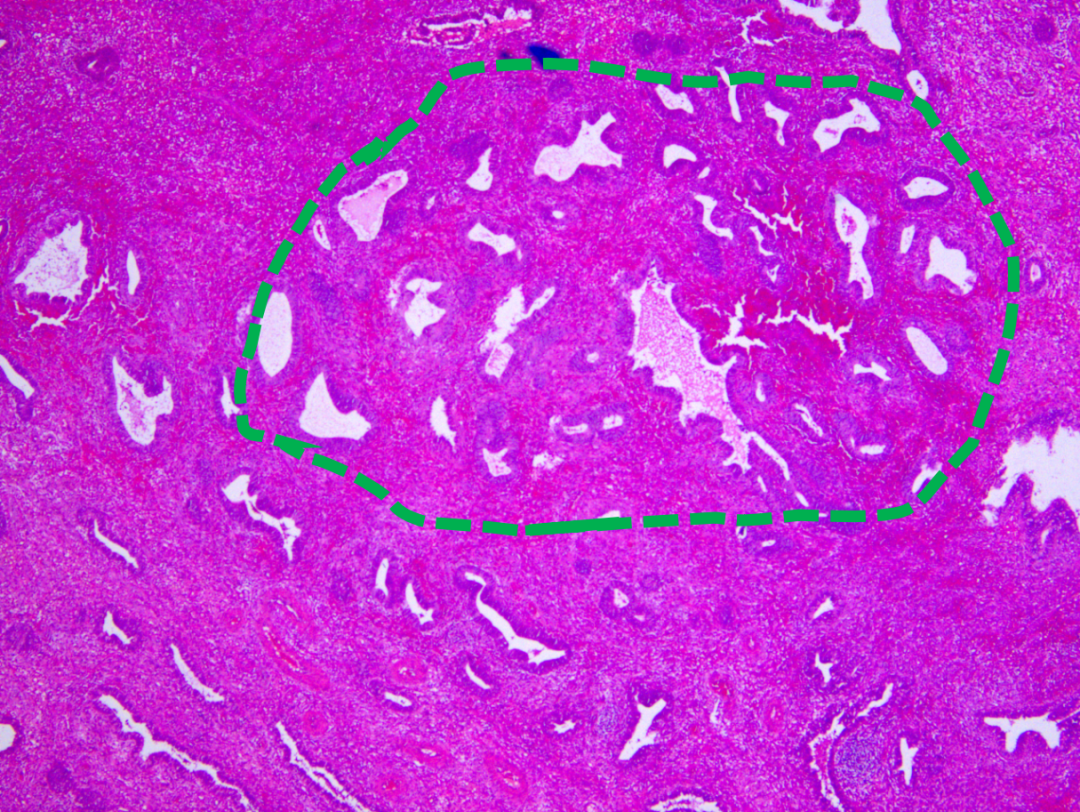
图示:息肉内部局部腺体略显密集(绿色虚线)。
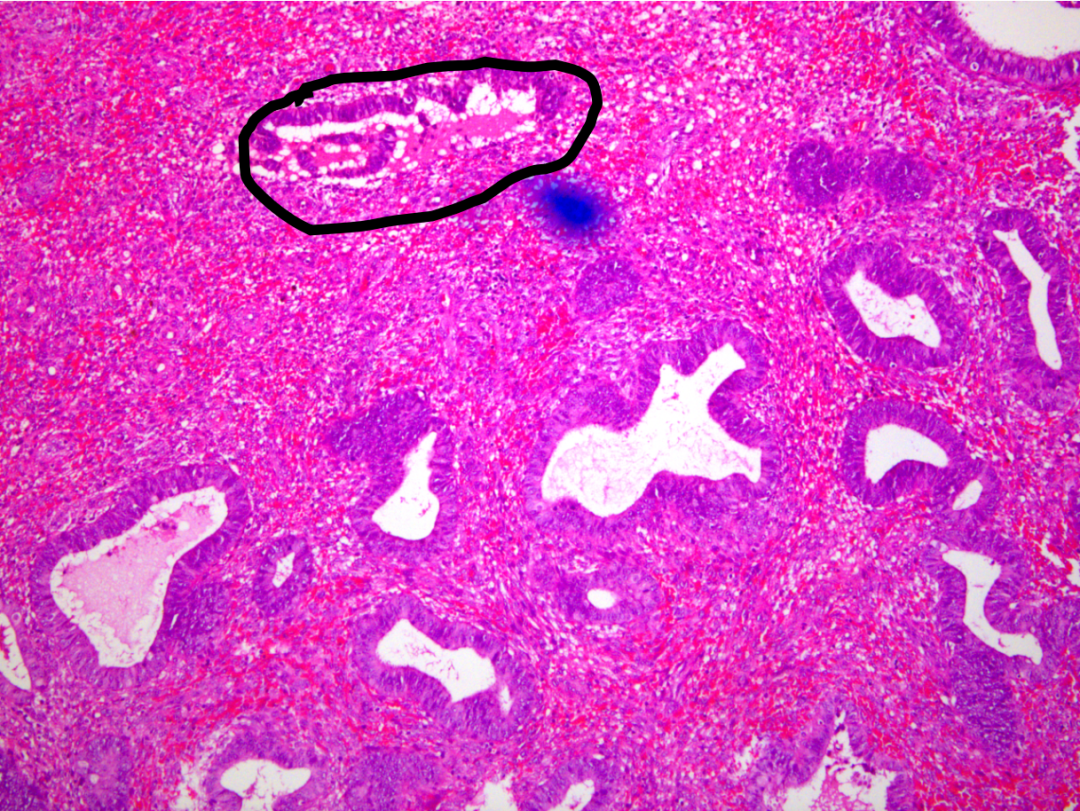
图示:密集区域腺体细胞学与背景腺体(黑色实线)有差异。
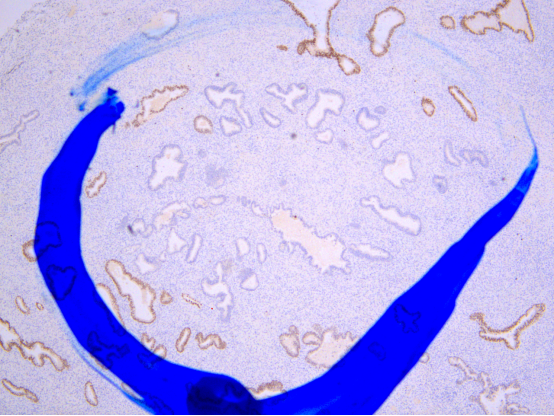
图示:密集区域腺体PAX2表达缺失。
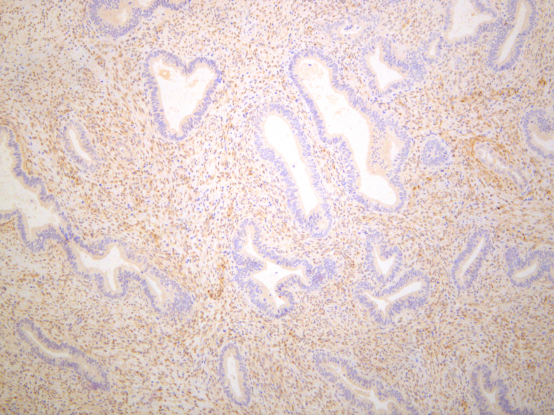
图示:PTEN弱表达,视为阳性表达。
病例讨论实例
患者信息:49岁女性,因阴道不规则出血行诊刮术。
HE染色切片:
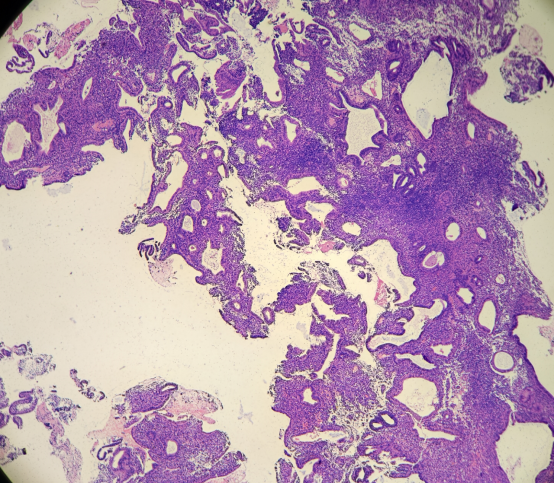
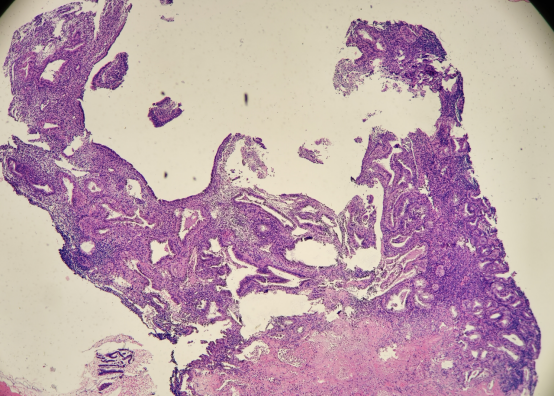
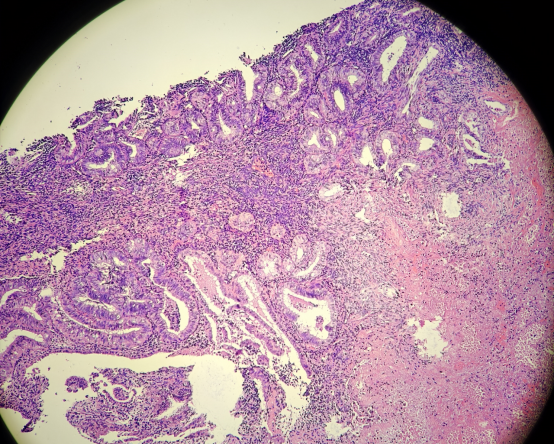
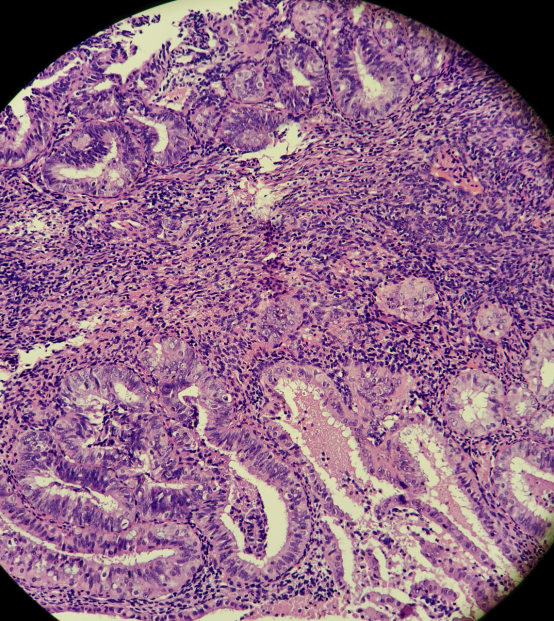
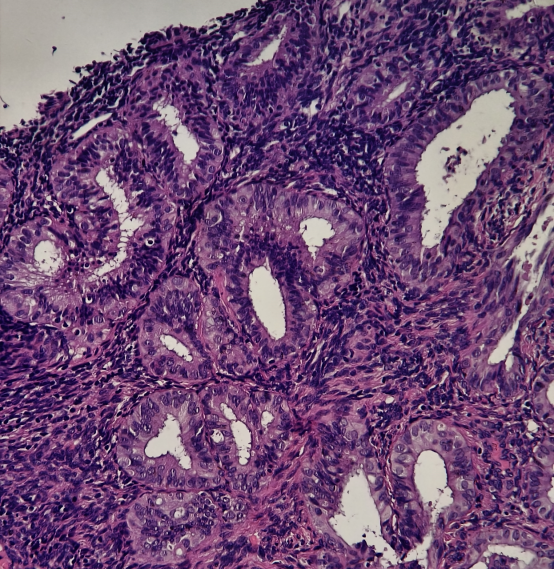
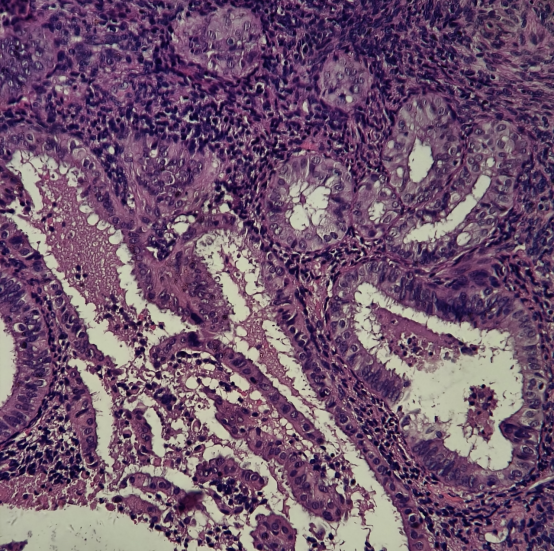
免疫组化结果:
PTEN:
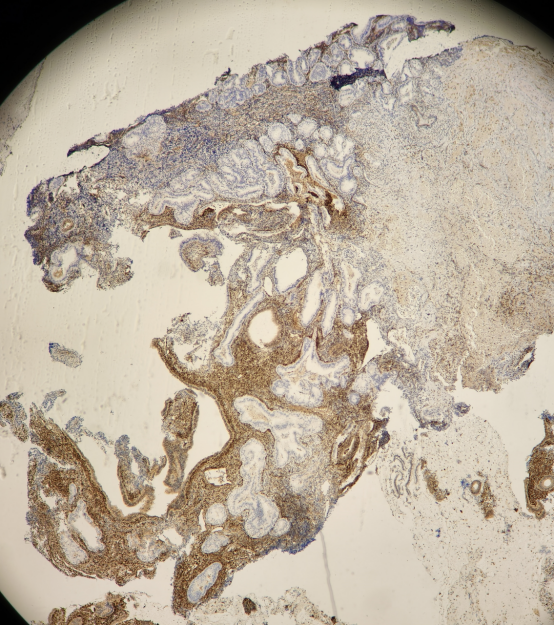
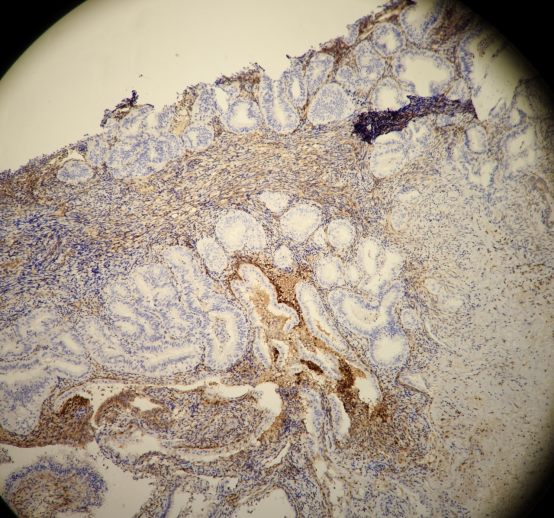
PAX2:
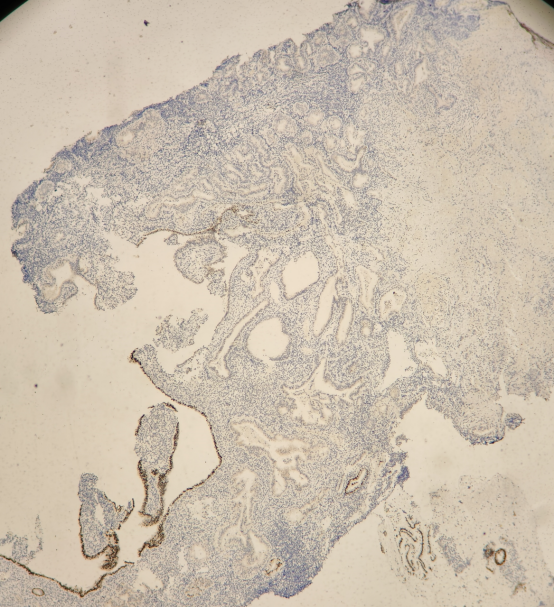
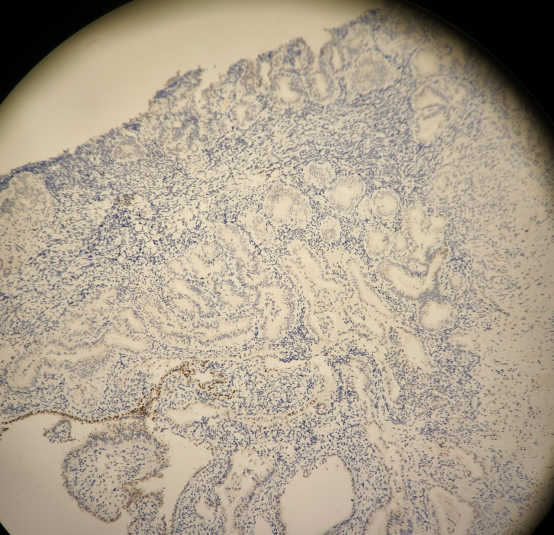
结果判读:组织中可见多灶性病变区域同时出现PTEN和PAX2的表达缺失。结合形态学改变,支持AH/EIN的诊断。
总结:
AH/EIN的诊断依赖于仔细的形态学评估和对鉴别诊断的充分认识。生物标志物,特别是PAX2、PTEN和β-catenin的联合应用,为疑难病例提供了重要的辅助诊断依据。准确诊断AH/EIN对于后续的临床决策,包括是否需要手术、药物治疗或密切随访至关重要。面对复杂的病理结果,寻求专业解读至关重要。如需进一步咨询或获取第二诊疗意见,MedFind AI问诊服务可提供参考。同时,您也可以在MedFind资讯板块了解更多关于子宫内膜癌及相关疾病的前沿信息。
参考资料(略)





