癌症的早期精准诊断对于改善患者预后至关重要。磁共振成像(MRI)因其高分辨率、优异的软组织对比度和无电离辐射等优点,已成为临床上不可或缺的肿瘤检测工具。然而,传统MRI造影剂在特异性方面存在局限性,难以完全满足精准诊断的需求。
传统造影剂的挑战与新策略的提出
以往的研究利用极小氧化铁纳米粒子(ESIONPs)的信号切换特性,开发了响应肿瘤微环境(如pH值或特定酶)的“T1-T2”或“T2-T1”切换型造影剂。但这些仅针对单一生物标志物的探针,在复杂的生理环境中容易受到非特异性因素的干扰,影响诊断的准确性。此外,体内固有的伪影,例如脂肪组织、钙化点、出血或空气腔,也可能在MRI图像上产生与病灶相似的亮或暗信号,给判读带来困难。
为了克服这些挑战,中国科学院苏州纳米技术与纳米仿生研究所的裴仁军研究员团队近期在《Biomaterials》杂志上报道了一种创新的“时间分辨”策略驱动的顺序性双次MRI信号切换造影剂(LESPH)。这项研究巧妙地利用了肿瘤微环境中两个关键特征——弱酸性环境和高水平谷胱甘肽(GSH),通过设计对这两个标志物响应速度的差异,实现了在时间维度上可区分的MRI信号变化。
这种“时间分辨”方法不仅增强了肿瘤识别的特异性,更重要的是,它能够有效排除内源性伪影的干扰,实现一种可靠的自我确认交叉验证,从而显著提高肿瘤诊断的准确率(图1)。
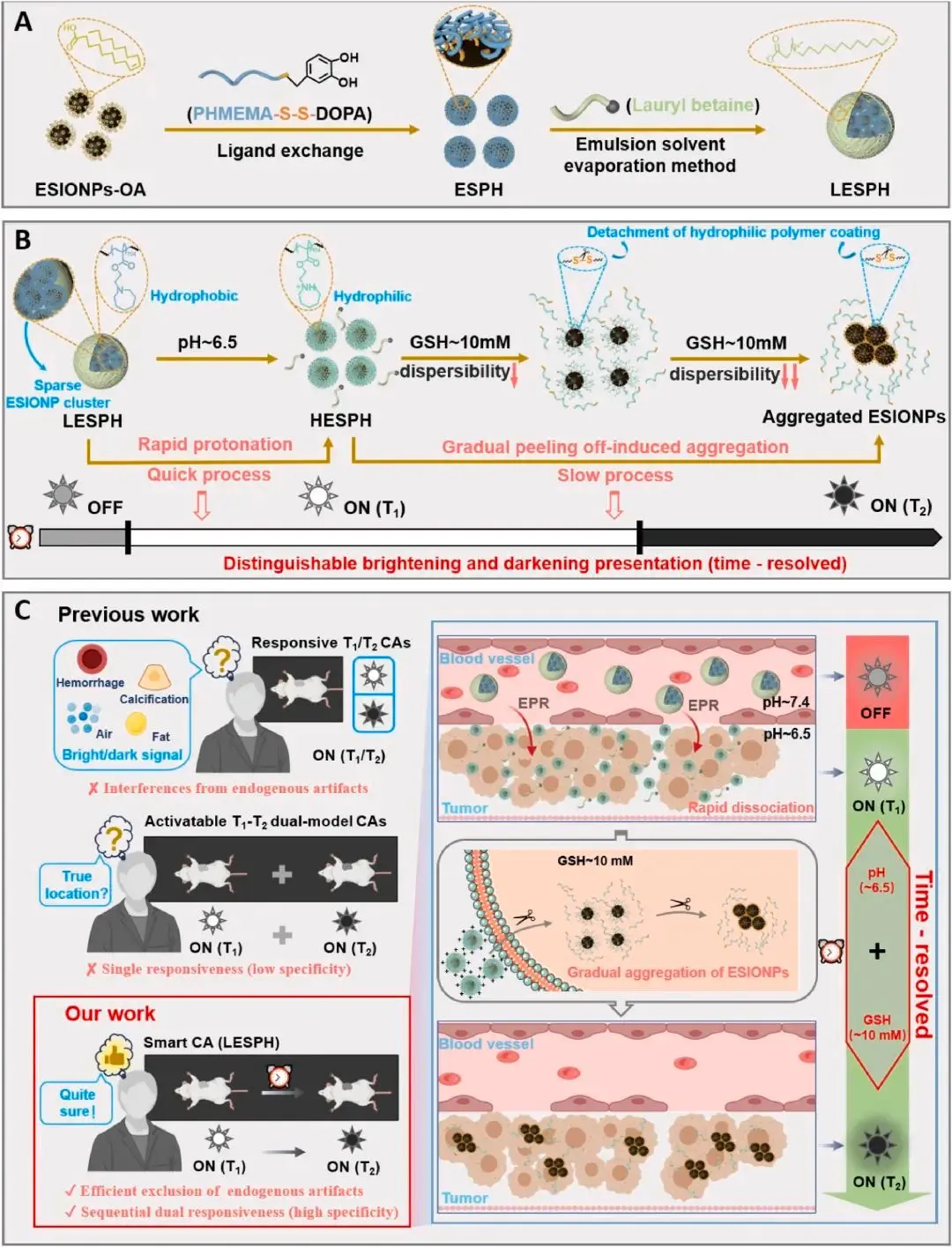
图1. LESPH的构建及其“时间分辨”策略示意图
LESPH的设计与响应机制
研究团队首先合成了一种对弱酸和GSH均能响应的聚合物DSPH,然后将其修饰到ESIONP表面得到ESPH。最后,通过乳液溶剂蒸发法将ESPH自组装成大小约100纳米、结构相对疏松的纳米粒子LESPH。
在模拟肿瘤微环境的条件下,对LESPH的响应性进行了表征。透射电子显微镜(TEM)观察结果直观地显示,LESPH在先后经历弱酸和GSH刺激后,其结构发生了从解离(分散)到紧密聚集的顺序性变化(图2)。
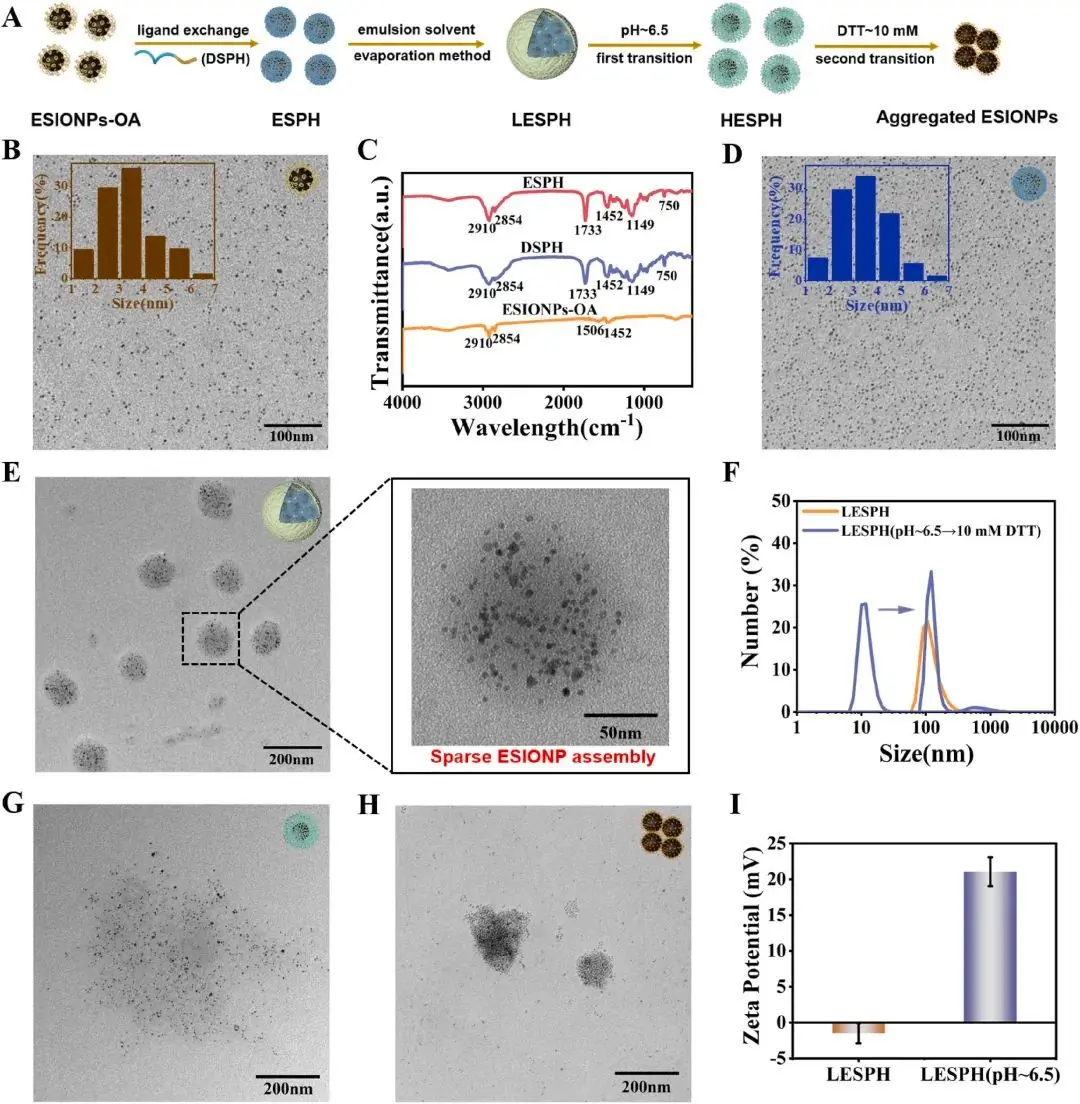
图2. LESPH的制备及响应性表征。
时间分辨的MRI信号切换
ESIONPs的结构动态变化直接影响其MRI信号。研究人员通过实时监测LESPH在双重刺激下的弛豫特性变化,发现该纳米探针经历了“稀疏组装 → 分散 → 紧密聚集”的两次连续结构转变。这一过程对应着MRI信号的“OFF → T1增强 → T2增强”的顺序演化。这种独特的时间分辨信号切换模式,为MRI肿瘤诊断提供了一种全新的时空对比调控策略(图3)。
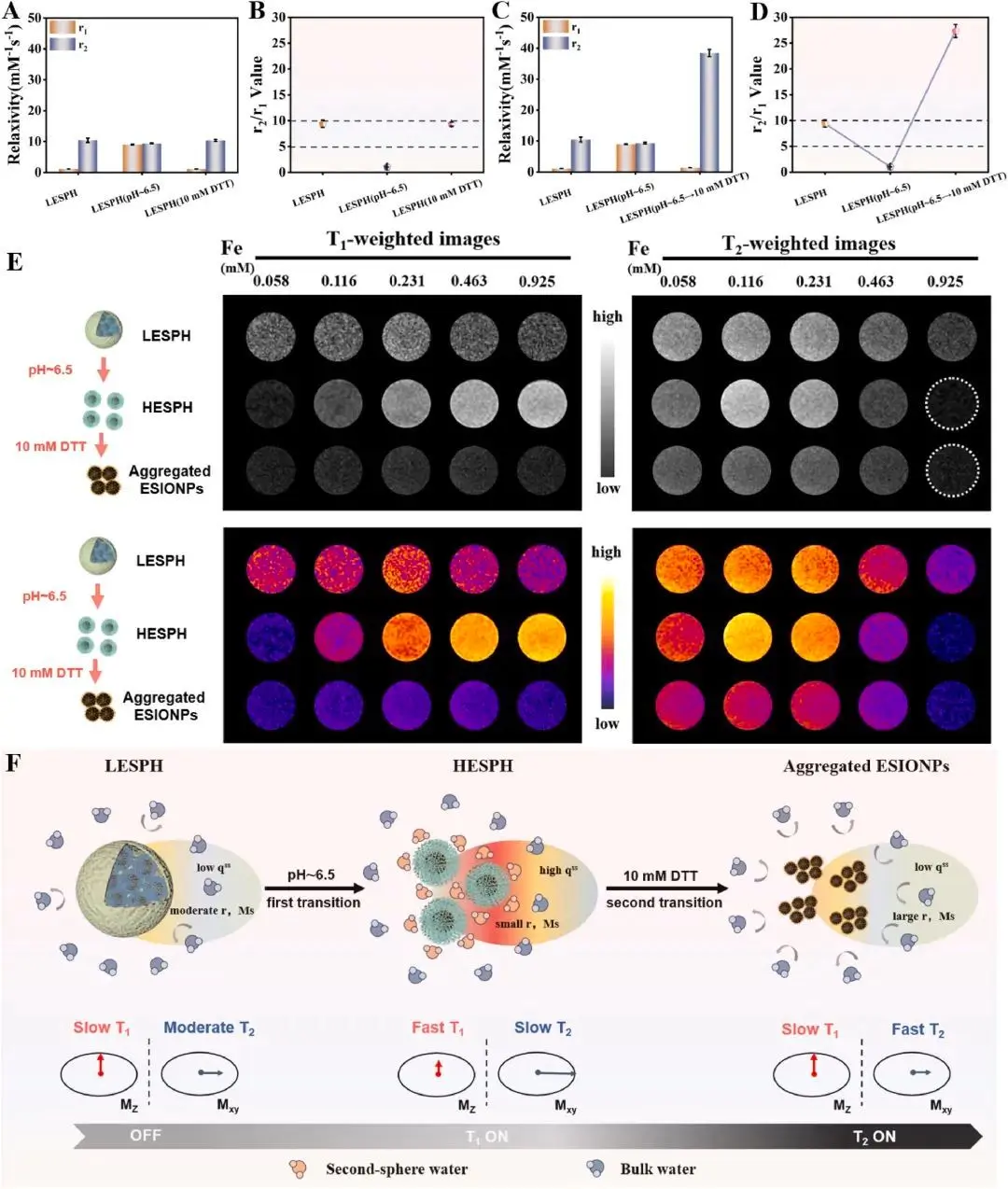
图3. LESPH的驰豫性能表征。
体内验证:精准识别肿瘤并排除干扰
在荷瘤小鼠模型上的体内实验进一步验证了LESPH的有效性。静脉注射LESPH后,纳米粒子通过增强渗透长滞留(EPR)效应富集于肿瘤部位。
关键在于其时间分辨响应:
- 早期(快速响应):肿瘤微环境的弱酸性首先快速触发LESPH结构的部分解离,导致T1信号显著增强(肿瘤区域变亮)。
- 晚期(缓慢响应):随后,肿瘤细胞内高浓度的GSH缓慢地作用于LESPH,促使其发生紧密聚集,导致T2信号增强(肿瘤区域变暗)。
这种在不同时间点先后出现的T1和T2信号变化,如同为肿瘤诊断提供了“双重确认”,极大地提升了诊断的可靠性(图4)。
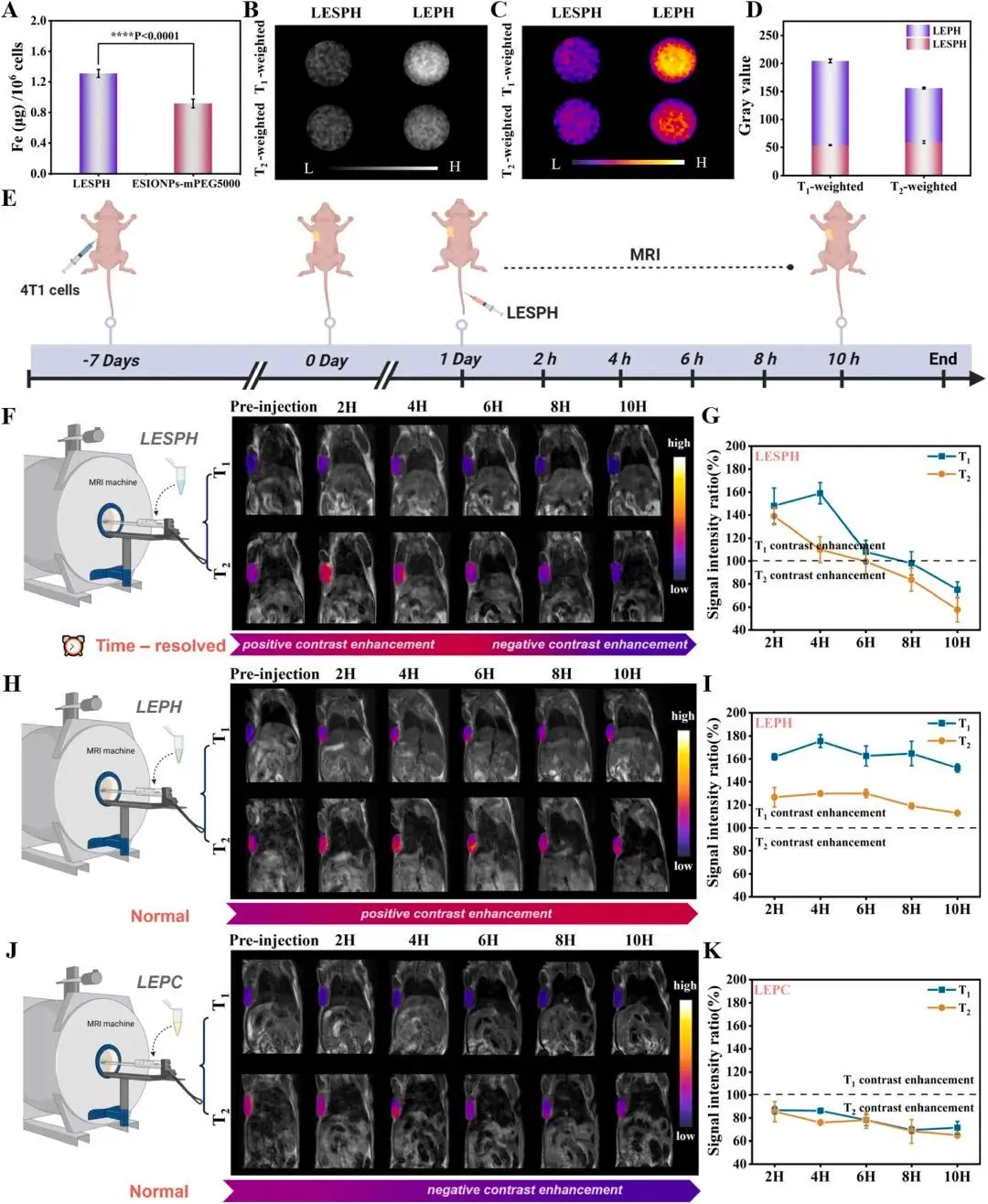
图4. 细胞及荷瘤小鼠MRI验证。
为了模拟临床诊断中可能遇到的干扰,研究人员还构建了体外植入脂肪和空气的荷瘤小鼠模型。结果显示,LESPH凭借其独特的时间分辨对比增强特性,能够成功区分肿瘤组织与脂肪、空气等内源性伪影信号。在早期T1成像时,肿瘤和脂肪都可能呈现亮信号,但在晚期T2成像时,只有肿瘤区域会因GSH响应而变暗,脂肪信号则无此变化,从而有效排除了干扰,真正让肿瘤“无所遁形”(图5)。
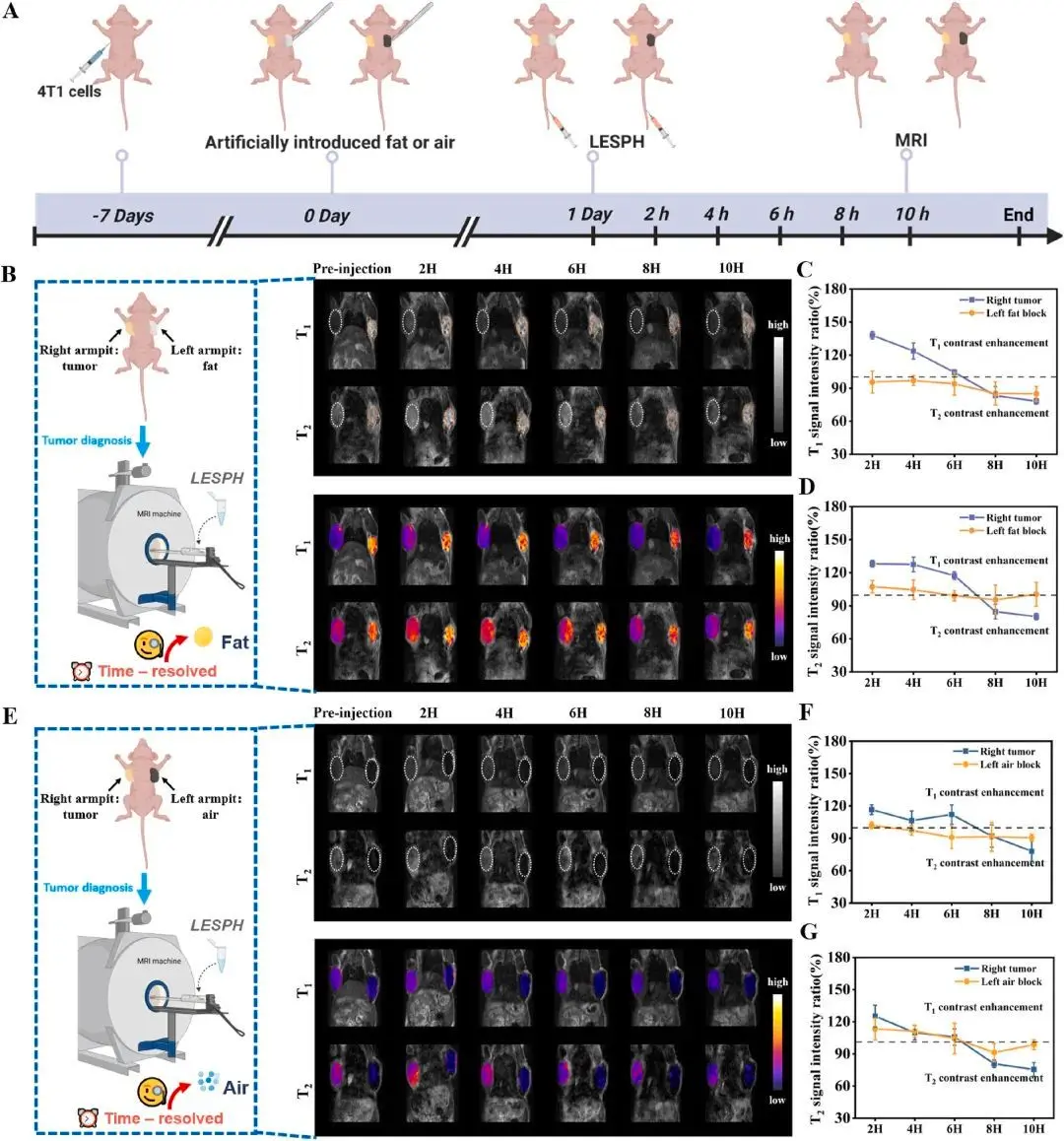
图5. 体外植入脂肪及空气荷瘤小鼠MRI验证。
研究意义与展望
与现有的响应型MRI造影剂相比,LESPH的顺序双响应特性和时间分辨对比增强功能是其突出优势。它不仅提高了对肿瘤微环境识别的特异性,更重要的是解决了内源性伪影干扰这一诊断痛点,显著提升了MRI在肿瘤诊断中的准确性和可靠性。
这项研究代表了癌症精准诊断领域的重大进展。准确的诊断是制定有效癌症治疗方案(包括靶向药和仿制药选择)的基础。获取更多前沿抗癌资讯,了解最新的诊断和治疗动态,欢迎访问MedFind<0xC2><0xA0>[抗癌资讯](https://medfind.link/info)<0xC2><0xA0>板块。
该研究论文的第一作者为中科院苏州纳米所博士生芦忠忠,通讯作者为曹翼副研究员、裴仁军研究员和张晔副研究员。研究得到了国家自然科学基金、江苏省自然科学基金等项目的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961225002327