CAR-T疗法的瓶颈与挑战
CAR-T细胞疗法作为免疫治疗领域的明星,已在白血病等血液肿瘤治疗中展现了非凡的潜力,为无数患者带来了新生。然而,在占据癌症病例90%的实体瘤面前,CAR-T疗法的威力却大打折扣。实体瘤复杂的微环境会持续“消耗”T细胞,使其陷入“耗竭”状态,最终丧失抗癌活性。为了增强T细胞的战斗力,科学家们尝试使用传统的CRISPR基因编辑技术进行多重改造,但这如同“伤敌一千,自损八百”,切割DNA双链的操作极易引发细胞毒性、DNA损伤甚至染色体异常,安全性风险较高。对于寻求前沿治疗方案的患者而言,及时了解最新的抗癌资讯至关重要。
革命性技术:无损DNA的“表观遗传编程”
近日,发表于国际顶尖期刊《Nature Biotechnology》的一项研究为突破CAR-T疗法的困境带来了希望。来自格拉斯通-加州大学旧金山分校的科学家们成功开发了一套全新的“表观遗传编程”平台——CRISPRoff与CRISPRon。
与传统CRISPR技术粗暴的“剪切”模式不同,这套新系统堪称“基因调光师”。它通过在基因的特定区域添加或移除“甲基化标签”,来精准地开启或关闭基因表达,整个过程完全不触及、不损伤宝贵的DNA序列。这种“写入记忆”的方式非常持久,研究人员发现,即使只对T细胞进行两三天的编辑处理,其基因沉默效果也能在数十次细胞分裂和多次免疫激活后得以维持。
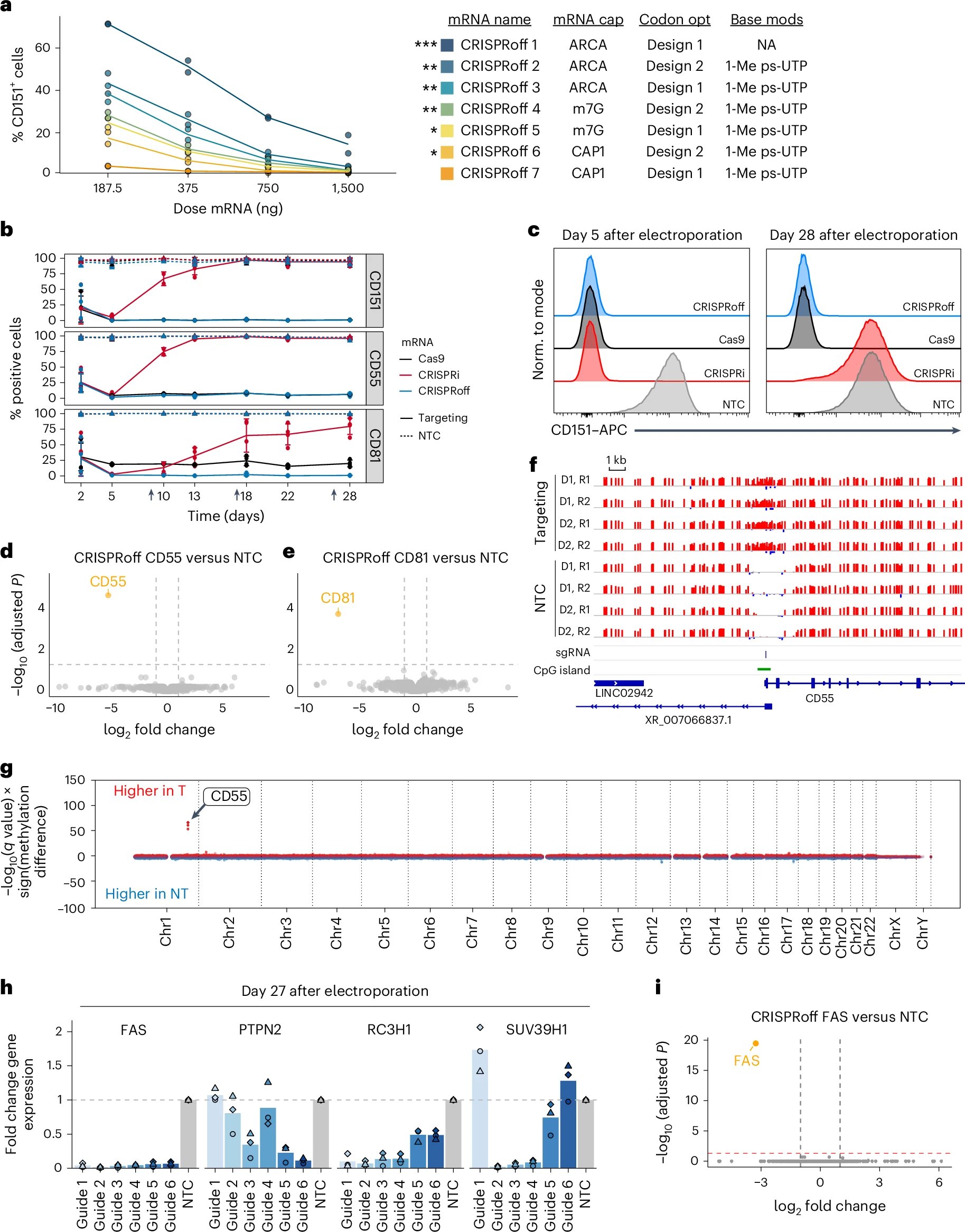
图示:CRISPRoff技术在原代人T细胞中实现特异性且持久的转录沉默
“双重强化”T细胞:实验效果显著
为了验证该技术的实战能力,研究团队进行了一项精妙的实验。他们将遗传工程与表观遗传工程相结合:
- 第一步 (遗传工程): 使用CRISPR Cas12a技术,为T细胞精准安装能够识别癌细胞的CAR导航系统。
- 第二步 (表观遗传工程): 同时使用CRISPRoff技术,沉默一个名为RASA2的基因。该基因在T细胞内扮演着“分子刹车”的角色,抑制其活化。
实验结果令人振奋。经过“双重强化”的CAR-T细胞,在实验室中面对肿瘤细胞的反复攻击,依然保持着旺盛的战斗力,而未经改造的普通CAR-T细胞早已“精疲力竭”。在白血病小鼠模型中,这种强化版CAR-T细胞也展现出更强的肿瘤抑制效果,并显著提高了小鼠的生存率。
临床应用前景广阔
这项新技术的最大优势之一在于其能够与现有的CAR-T生产工艺无缝对接,只需将研究级试剂替换为临床级版本,便有望快速推向临床试验。研究人员表示,他们不仅是为细胞安装了导航,更是系统性地重编程了其功能模式,为未来的细胞治疗开辟了新思路。如果您对现有疗法或前沿技术有疑问,可以咨询MedFind的AI问诊服务,获取个性化信息。
如果说传统基因编辑是“改写生命说明书”,那么这项表观遗传编程技术就是“为细胞写入可执行的记忆代码”。它标志着细胞治疗正从“修补”迈向可编程、可扩展的精准调控新时代,为攻克实体瘤等医学难题注入了“不灭的战斗意志”。在等待新技术的同时,患者也可以通过MedFind代购服务获取已获批的有效药物,不错过任何治疗机会。