导语:胃癌作为全球高发的恶性肿瘤之一,其治疗策略正经历着快速变革。尤其对于晚期胃癌患者,精准治疗已成为提升生存率的关键。2024年,中国临床肿瘤协会(CSCO)、美国国家综合癌症网络(NCCN)和欧洲肿瘤内科学会(ESMO)相继更新了胃癌诊疗指南。本文将深入对比这三大权威指南在晚期胃癌治疗策略上的异同,特别关注基于HER2、PD-L1、MMR状态以及新靶点CLDN18.2等的精准治疗方案,希望能为患者和临床医生提供有价值的参考。
胃癌在全球范围内具有高发病率和高侵袭性的特点,总体预后仍面临挑战。值得注意的是,东西方人群在胃癌的流行病学、病理特征、治疗模式及药物选择上存在明显差异。近年来,靶向治疗和免疫治疗的飞速发展,结合精准医疗理念的成熟和多学科协作的推广,催生了众多临床研究成果,推动了胃癌指南的持续更新。
本文聚焦不可手术切除的局部晚期或转移性胃食管结合部腺癌及胃腺癌的治疗策略,对比分析NCCN(2024年V5版)、ESMO(2024版)和CSCO(2024版)三大指南的最新内容。重点关注基于生物标志物的个体化治疗,如:
- HER2(人表皮生长因子受体2)阳性胃癌的全线抗HER2治疗,特别是ADC药物(抗体药物偶联物)在一线曲妥珠单抗耐药后的应用。
- PD-L1(程序性死亡受体配体1)表达指导下的免疫治疗联合化疗方案。
- MMR(错配修复蛋白)状态在免疫治疗选择中的作用。
- 新靶点如CLDN18.2(Claudin 18.2)的靶向治疗进展。
三大指南融合了最新的临床研究数据、药物批准情况及各地医疗体系实情。特别是CSCO指南,充分体现了中国自主研发药物的进步和针对中国人群研究的成果。虽然指南在靶向、免疫等新疗法的推荐上存在差异,但这种差异性也丰富了临床决策的维度,有助于提升循证医学指南的临床适用性。
一、晚期不可切除或转移性胃癌一线治疗策略对比
对于失去手术根治机会的晚期胃癌患者,三大指南均推荐以全身药物治疗为主的综合策略。治疗方案的选择需综合考虑患者年龄、体能、伴随疾病、既往治疗、意愿、经济状况及药物可及性等因素。主要差异体现在新疗法(靶向、免疫)的推荐细节上。
核心分层依据:
- HER2表达状态
- MMR状态(dMMR/MSI-H vs pMMR/MSS)
- PD-L1表达水平(尤其在HER2阴性人群中)
- CLDN18.2表达状态(NCCN/ESMO新增)
- AFP(甲胎蛋白)水平(CSCO新增)
1.1 HER2阳性晚期胃癌一线治疗
对于HER2阳性(IHC 3+ 或 IHC 2+/FISH+)的晚期胃癌,三大指南推荐趋于一致,并根据PD-L1表达进一步细化:
- PD-L1 CPS≥1:推荐帕博利珠单抗联合曲妥珠单抗和化疗(优选含奥沙利铂方案,如XELOX)。此推荐基于KEYNOTE-811研究结果,显示联合治疗显著提高ORR。
- PD-L1 CPS<1:推荐曲妥珠单抗联合化疗(优选含奥沙利铂方案)。
这一策略已在美国、欧盟和中国获批。化疗方案选择上,奥沙利铂因其较好的耐受性被优先推荐。
1.2 HER2阴性晚期胃癌一线治疗
对于HER2阴性患者,三大指南均推荐基于PD-L1表达水平决定是否联合免疫检查点抑制剂(ICI)。
- 化疗方案:均推荐氟尿嘧啶联合铂类(优选奥沙利铂)。ESMO不建议FLOT方案联合免疫治疗,因毒性增加。
- 免疫联合策略:NCCN:基于Checkmate 649和KEYNOTE-859研究,对PD-L1 CPS≥5推荐纳武利尤单抗+化疗(1类);对CPS≥1推荐帕博利珠单抗+化疗(CPS≥10为1类,CPS 1-9为2B类);对CPS<5,特定情况考虑纳武利尤单抗+化疗(2B类)。
- ESMO:基于Checkmate 649和KEYNOTE-859研究,对PD-L1 CPS≥5推荐纳武利尤单抗+化疗;对CPS 1-4考虑纳武利尤单抗+化疗。对CPS≥10推荐帕博利珠单抗+化疗;对CPS 1-9考虑帕博利珠单抗+化疗。推荐分层考虑了疗效与PD-L1表达的相关性及不同地区药物批准情况。
- CSCO:推荐更广泛,纳入更多国产及进口ICI(纳武利尤单抗、帕博利珠单抗、信迪利单抗、替雷利珠单抗、舒格利单抗、卡度尼利单抗等),并根据不同研究(CheckMate 649, ORIENT-16, RATIONALE-305, KEYNOTE-859, GEMSTONE-303, COMPASSION-15)和PD-L1检测方法/阈值进行细化推荐。值得注意的是,CSCO对PD-L1低表达(甚至CPS<1或检测不可及)患者,在无禁忌证时,也将免疫联合化疗列为Ⅱ级推荐(1B类),并考虑了帕博利珠单抗单药用于特定人群(Ⅲ级推荐,2B类)。卡度尼利单抗联合化疗在PD-L1低表达人群显示获益,以注释形式增加。
对于考虑使用这些前沿免疫药物的患者,了解其海外代购渠道和价格信息可能有助于治疗决策。
1.3 dMMR/MSI-H晚期胃癌一线治疗
dMMR/MSI-H约占晚期胃癌的5%,对免疫治疗反应良好。三大指南均推荐免疫治疗,但具体方案和推荐级别有差异:
- NCCN:依次推荐帕博利珠单抗或多塔利单抗、纳武利尤单抗+伊匹木单抗、纳武利尤单抗+化疗、帕博利珠单抗+化疗。
- ESMO:推荐免疫治疗,但单药或联合化疗的选择需个体化考虑(如肿瘤负荷大、症状重者可考虑联合)。
- CSCO:依次推荐纳武利尤单抗+伊匹木单抗(Ⅱ级,2B类)、帕博利珠单抗(Ⅱ级,2B类)、纳武利尤单抗+化疗(Ⅲ级,2B类)、帕博利珠单抗+化疗(Ⅲ级,2B类)。同时,基于中国国情和药物可及性,其他已上市ICI也可作为Ⅲ级推荐(3类)。
1.4 产AFP胃癌一线治疗(CSCO特色)
CSCO指南新增了对产AFP(甲胎蛋白)胃癌亚型(约占3%,预后差)的管理。基于一项Ⅱ期研究结果,新增SOX(S1+奥沙利铂)联合卡瑞利珠单抗/阿帕替尼方案作为Ⅱ级推荐。
1.5 CLDN18.2阳性晚期胃癌一线治疗(NCCN/ESMO新增)
NCCN和ESMO指南将CLDN18.2作为HER2阴性患者的新分层标志物。对于pMMR、HER2阴性且CLDN18.2强阳性(≥75%细胞膜染色≥2+)的患者,推荐化疗联合佐妥昔单抗(Zolbetuximab)。此推荐基于SPOTLIGHT和GLOW研究结果。由于该适应证在中国尚未获批,CSCO指南以注释形式提及。CLDN18.2被视为胃癌领域继HER2后的重要靶点,相关ADC、双抗、CAR-T等新药研发活跃。
二、晚期不可切除或转移性胃癌二线及后线治疗策略
二线及后线治疗同样强调生物标志物指导下的精准分层。
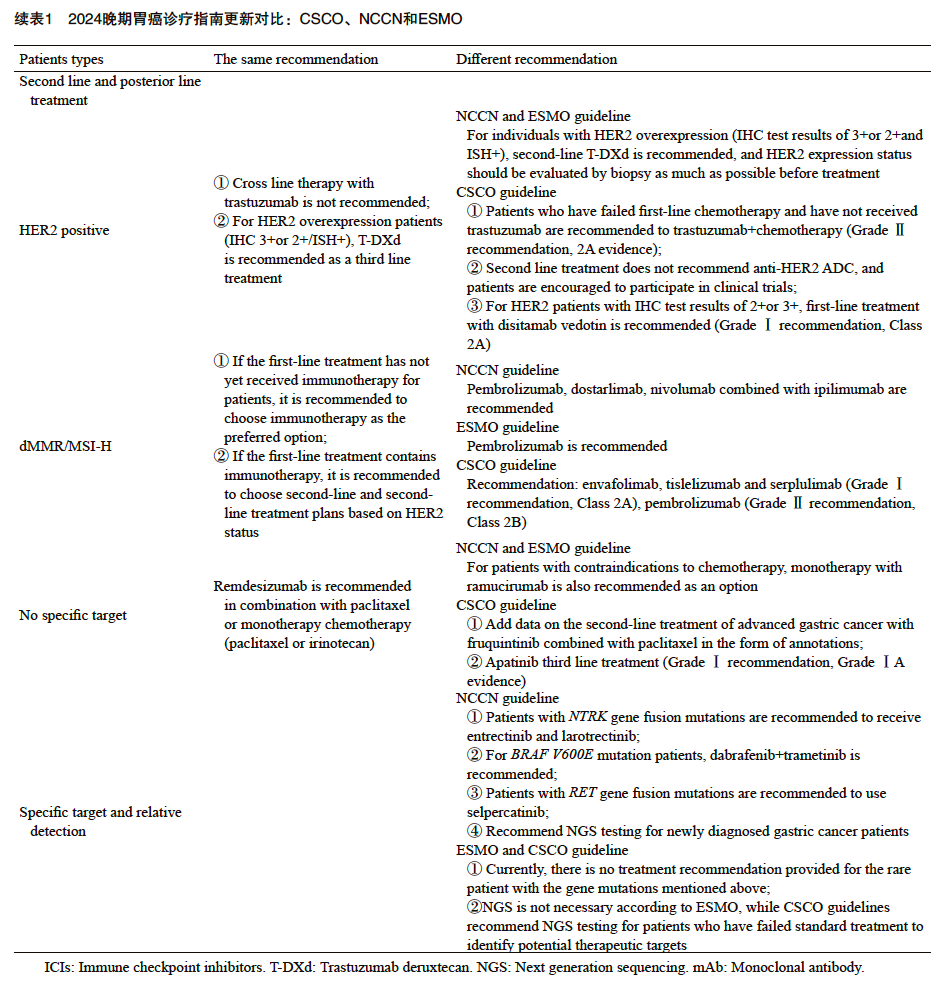
2.1 HER2阳性人群二线及后线治疗
- NCCN/ESMO:不推荐曲妥珠单抗跨线使用。推荐德曲妥珠单抗(Trastuzumab deruxtecan, T-DXd)用于二线及后线治疗(基于DESTINY-Gastric01/02研究),建议治疗前再活检评估HER2状态。
- CSCO:仅对既往未用过曲妥珠单抗的HER2阳性患者推荐曲妥珠单抗联合紫杉醇(Ⅱ级,2A类)。不推荐曲妥珠单抗跨线。三线优先推荐抗HER2 ADC药物,包括维迪西妥单抗(Disitamab Vedotin, RC48,基于C008研究)和德曲妥珠单抗(基于DESTINY-Gastric06中国桥接研究),根据不同研究人群和获批适应证选择。
对于德曲妥珠单抗等新型ADC药物,患者可通过MedFind平台了解海外购买途径。
2.2 dMMR/MSI-H患者二线及后线治疗
若一线未使用ICI,三大指南均推荐在后线使用免疫治疗。
- ESMO:推荐帕博利珠单抗。
- NCCN:推荐帕博利珠单抗、多塔利单抗、纳武利尤单抗+伊匹木单抗。
- CSCO:推荐更广泛,包括恩沃利单抗(Envafolimab)、替雷利珠单抗、斯鲁利单抗(Serplulimab)(均为Ⅰ级,2A类,基于各自Ⅱ期研究),以及帕博利珠单抗(Ⅱ级,2B类)。若一线已用免疫治疗,则按HER2状态选择后续方案。
2.3 无特定靶点人群二线及后线治疗
对于无明确驱动基因或生物标志物的患者:
- 二线治疗:三大指南均推荐雷莫西尤单抗联合紫杉类药物,或单药化疗(紫杉类/伊立替康)。NCCN/ESMO还将雷莫西尤单抗单药作为化疗禁忌者的选择。CSCO以注释形式增加了呋喹替尼联合紫杉醇的数据(基于FRUTIGA研究)。
- 三线治疗:CSCO推荐阿帕替尼(Ⅰ级,1A类,基于其Ⅲ期研究结果及NMPA批准)。
2.4 特定靶点人群后线治疗及分子检测
对于罕见突变:
- NCCN:对NTRK融合推荐恩曲替尼或拉罗替尼;对BRAF V600E突变推荐达拉非尼+曲美替尼;对RET融合推荐塞普替尼。
- CSCO/ESMO:目前未对这些罕见靶点给出具体治疗建议。
分子检测推荐:
- 三大指南均推荐检测HER2、PD-L1、MSI-H/dMMR。
- NGS(二代测序):ESMO未推荐;CSCO推荐标准治疗失败后进行NGS寻找潜在靶点;NCCN首次推荐所有新确诊胃癌患者进行NGS检测。
进行全面的分子检测有助于制定更精准的治疗方案。患者可以考虑使用MedFind的AI问诊服务,结合自身检测报告获取个性化治疗信息解读。
三、总结与展望
2024年三大胃癌指南均体现了晚期胃癌治疗向生物标志物指导的精准化、个体化方向发展的趋势。HER2、PD-L1、MMR状态已成为关键分层依据,CLDN18.2等新靶点崭露头角。
- HER2阳性胃癌:进入全线抗HER2治疗时代,ADC药物成为后线标准选择。
- HER2阴性胃癌:免疫联合化疗成为一线主流,但需根据PD-L1表达精准选择获益人群和方案。PD-L1检测的标准化和可及性仍是挑战。
- dMMR/MSI-H胃癌:免疫治疗地位稳固。
- 新靶点与新药:CLDN18.2靶向药(如佐妥昔单抗)、针对NTRK/BRAF/RET等罕见靶点的药物为特定患者带来希望。
指南间的差异反映了地区临床实践侧重、药物可及性(特别是国产创新药)以及医疗体系的不同。CSCO指南更贴合中国国情,纳入了更多基于中国人群数据和已获批的国产药物。三大指南的更新都强调了综合评估、个体化分层管理的重要性,为临床决策提供了宝贵依据。
未来,随着更多临床研究的开展和新药的涌现,胃癌的治疗格局将持续演变。对于患者而言,及时了解最新的诊疗进展,积极进行相关分子检测,并与医生充分沟通,选择最适合自己的治疗方案至关重要。
作者简介:
蓝 煜,中山大学肿瘤防治中心硕士研究生。
通信作者:
王风华,博士,主任医师。
作者贡献声明:
蓝 煜:资料收集、文献检索及文章撰写;王风华:写作指导与审阅。


[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[3] J A N J I G I A N Y Y , K A W A Z O E A , B A I Y X , e t a l . Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial[J]. Lancet, 2023, 402(10418): 2197-2208.
[4] RHA S Y, KAWAZOE A, BAI Y, et al. Final overall survival for the phase Ⅲ, KEYNOTE-811 study of pembrolizumab plus trastuzumab and chemotherapy for HER2+ advanced, unresectable or metastatic G/GEJ adenocarcinoma[J]. Ann Oncol, 2024, 35: S1453-S1454.
[5] JANJIGIAN Y Y, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[6] RHA S Y, OH D Y, YAÑEZ P, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2- negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2023, 24(11): 1181-1195.
[7] KANG Y K, CHEN L T, RYU M H, et al. Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2022, 23(2): 234-247.
[8] XU J M, JIANG H P, PAN Y Y, et al. Sintilimab plus chemotherapy for unresectable gastric or gastroesophageal junction cancer: the ORIENT-16 randomized clinical trial[J]. JAMA, 2023, 330(21): 2064-2074.
[9] QIU M Z, OH D Y, KATO K, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial[J]. BMJ, 2024, 385: e078876.
[10] ZHANG X, WANG J, WANG G, et al. Prespecified progressionfree survival (PFS) and overall survival (OS) final analyses of a phase Ⅲ study of sugemalimab plus chemotherapy vs placebo plus chemotherapy in treatment-naïve advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma[J]. Ann Oncol, 2023, 34: S1319.
[11] JI J F, ZIYU LI, ZHANG X T, GAO X Y, et al. Cadonilimab plus chemotherapy versus chemotherapy as first-line treatment for unresectable locally advanced or metastatic gastric or gastroesophageal junction (G/GEJ) adenocarcinoma (COMPASSION-15): a randomized, double-blind, phase 3 trial[C]. AACR, 2024.
[12] SHITARA K, VAN CUTSEM E, BANG Y J, et al. Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: the KEYNOTE-062 phase 3 randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1571-1580.
[13] WANG Y K, WANG C, CHEN X F, et al. Camrelizumab plus apatinib and SOX as first-line treatment in patients with alphafetoprotein-producing gastric or gastroesophageal junction adenocarcinoma: a single-arm, multi-center, phase 2 trial[J]. J Clin Oncol, 2024, 42(3_suppl): 351.
[14] SHITARA K, LORDICK F, BANG Y J, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet, 2023, 401(10389): 1655-1668.
[15] SHAH M A, SHITARA K, AJANI J A, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial[J]. Nat Med, 2023, 29(8): 2133-2141.
[16] SHITARA K, BANG Y J, IWASA S, et al. Trastuzumab deruxtecan in HER2-positive advanced gastric cancer: exploratory biomarker analysis of the randomized, phase 2 DESTINY-Gastric01 trial[J]. Nat Med, 2024, 30(7): 1933-1942.
[17] VAN CUTSEM E, DI BARTOLOMEO M, SMYTH E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumabcontaining regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study[J]. Lancet Oncol, 2023, 24(7): 744-756.
[18] THUSS-PATIENCE P C, SHAH M A, OHTSU A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study[J]. Lancet Oncol, 2017, 18(5): 640-653.
[19] PENG Z, LIU T S, WEI J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase Ⅱ study[J]. Cancer Commun (Lond), 2021, 41(11): 1173-1182.
[20] SHEN L, CHEN P, LU J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive locally advanced/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): primary efficacy and safety from the phase Ⅱ single-arm DESTINY-Gastric06 (DG06) trial[J]. Ann Oncol, 2023, 34: S1542-S1543.
[21] SHEN L, LI J, DENG Y H, et al. Envafolimab (KN035) in advanced tumors with mismatch-repair deficiency[J]. J Clin Oncol, 2020, 38(15_suppl): 3021.
[22] LI J, XU Y, ZANG A M, et al. A phase 2 study of tislelizumab monotherapy in patients with previously treated, locally advanced unresectable ormetastatic microsatellite instabilityhigh/ mismatch repair deficient solid tumors[J]. J Clin Oncol, 2021, 39(15_suppl): 2569.
[23] QIN S, LI J, ZHONG H, et al. Efficacy and safety of HLX10, a novel anti-PD-1 antibody, in patients with previously treated unresectable or metastatic microsatellite instabilityhigh or mismatch repair-deficient solid tumors: a single-arm, multicenter, phase 2 study[J] . J Clin Oncol, 2022.
[24] FUCHS C S, TOMASEK J, YONG C J, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial[J]. Lancet, 2014, 383(9911): 31-39.
[25] XU R H, WANG F, SHEN L, et al. Fruquintinib plus paclitaxel versus paclitaxel as second-line therapy for patients with advanced gastric or gastroesophageal junction adenocarcinoma (FRUTIGA): a randomized, multicenter, double-blind, placebocontrolled, phase 3 study[J]. J Clin Oncol, 2024, 42(36_suppl): 438780.
[26] LI J, QIN S K, XU J M, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016, 34(13): 1448-1454.