现代抗癌治疗:癌症患者手术麻醉的新背景
随着医学的进步,癌症患者的生存期显著延长,许多人实现了“与癌共存”。全身抗癌治疗(SACT)技术日新月异,超过半数的癌症患者生存期超过十年。这意味着,无论是在新辅助化疗阶段,还是在姑息性免疫治疗期间,患者都可能需要接受手术。这对麻醉管理带来了前所未有的挑战和复杂性。近期的研究表明,SACT不仅可能直接损伤器官,降低生理储备,还可能通过免疫抑制、代谢紊乱等方式形成“隐匿性脆弱链”,增加术后并发症的风险。2025年2月,《Anaesthesia》杂志发表的一篇综述系统梳理了SACT的作用机制及其与麻醉相关的毒性,提出了优化治疗时间窗、毒性分层预警和多模式预康复等策略,为改善癌症患者围手术期管理提供了新的思路。尤其在免疫治疗时代,麻醉需要从传统的生理监测转向整合分子药理学知识,以应对CTLA-4抑制剂相关的内分泌危象、PD-1单抗诱发的重症肌无力等新挑战。

全身抗癌治疗(SACT)的主要类型及其麻醉相关风险
癌症患者可能在治疗的任何阶段接受手术,因此麻醉医师必须对现代抗癌药物有广泛了解。SACT通常通过口服、静脉或皮下注射给药,按周期进行,每个周期之间有2-4周的间隔,以便正常组织恢复。治疗时长差异很大,从几个周期的化疗到长期使用耐受性良好的靶向治疗不等。
SACT主要用于新辅助治疗(术前)、辅助治疗(术后)和姑息治疗。对麻醉医师而言,最常见的是新辅助治疗场景。然而,随着姑息治疗效果提升,预期寿命延长,越来越多的姑息治疗患者也可能因紧急情况或计划性手术而需要麻醉。了解患者正在接受哪种SACT以及末次给药时间,对于评估麻醉风险至关重要。
细胞毒性化疗的常见影响
细胞毒性化疗通过干扰癌细胞增殖和DNA修复来发挥作用。其毒性与药物机制相关,可能影响多个系统,对围手术期安全构成威胁(详见下表)。
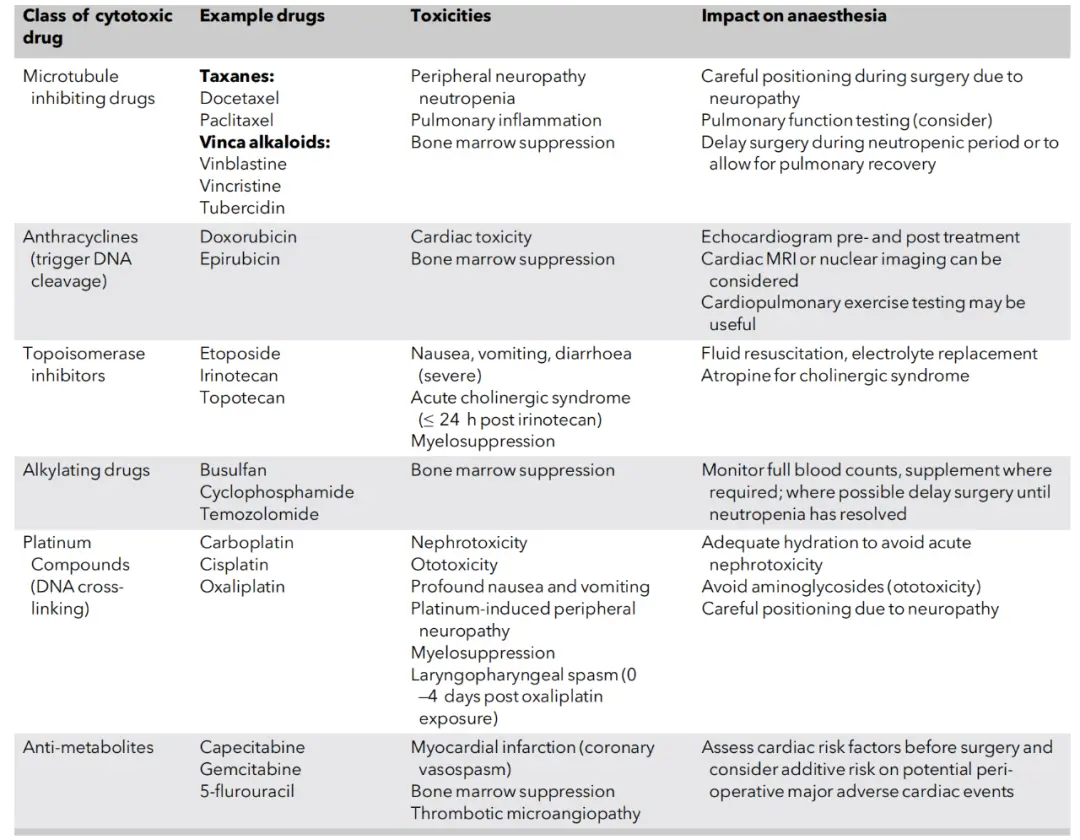
表2:常用细胞毒性化疗类别及其相关的麻醉相关毒性。
靶向治疗的精准打击与潜在风险
随着肿瘤基因组学的发展,靶向治疗能够精准作用于特定的分子靶点(如BCR-ABL融合基因)。然而,脱靶效应仍可能导致多器官损伤,麻醉管理中需特别关注药物特异性风险。例如,某些靶向药可能影响心脏功能或凝血机制。获取可靠的靶向药代购信息对维持治疗连续性很重要。
免疫治疗(如PD-1/CTLA-4抑制剂)的独特挑战
免疫治疗,特别是检查点抑制剂(如PD-1/PD-L1、CTLA-4单抗),通过解除免疫抑制显著改善了癌症预后。但它们也可能引发广泛的免疫相关不良事件(irAEs),主要影响肝脏、肠道、内分泌系统及神经肌肉组织。严重的并发症如肺炎、重症肌无力等需要早期使用大剂量糖皮质激素治疗。约20%的免疫毒性可能导致甲状腺、垂体等内分泌器官永久性损伤,这对长期麻醉用药和围术期代谢管理提出了特殊要求。
不同治疗阶段(新辅助/辅助/姑息)对麻醉管理的具体影响
SACT在不同治疗场景下对麻醉管理的影响各异(见下表)。新辅助治疗(如用于结直肠癌的FOLFOX方案,用于乳腺癌的AC-T方案)旨在术前缩小肿瘤,但也可能引起急性器官毒性,如蒽环类药物(如多柔比星)的心脏毒性、博来霉素的肺毒性、顺铂的肾毒性。虽然这些急性毒性在术前恢复期通常会减轻,但某些副作用如奥沙利铂相关的神经病变或免疫治疗诱导的内分泌损伤(如甲状腺功能异常)可能持续存在,需要在麻醉前仔细评估。
预康复策略(如体能训练、营养支持)有助于患者耐受复杂的SACT方案,但化疗导致的去适应状态(肌肉萎缩、心肺功能下降)仍会增加围术期风险。NEORES 2试验显示,延长术前恢复期(9-12周)虽有助于功能恢复,却可能增加食管癌复发风险。这要求麻醉科与肿瘤科紧密合作,制定个体化的手术时机。新辅助免疫治疗(如PD-1抑制剂)的普及,使得麻醉管理需更加关注免疫相关肺炎、心肌炎等新型并发症。
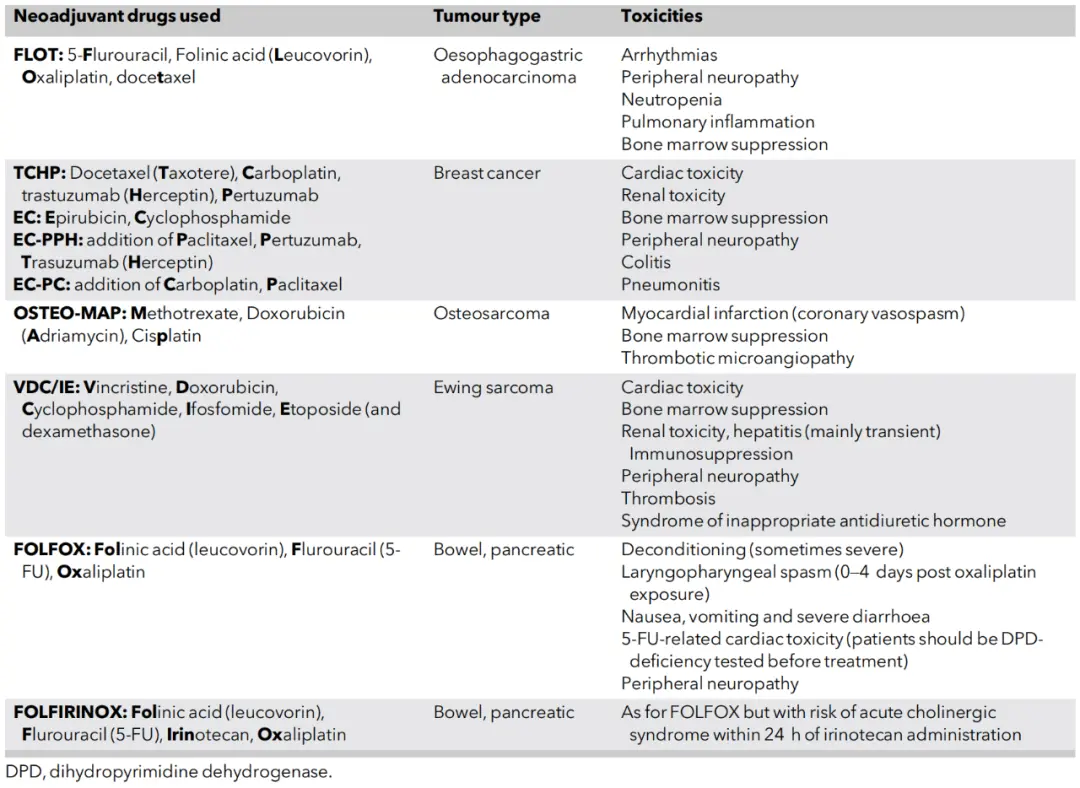
表3:常见的新辅助治疗方案及其常用缩写概述。
抗癌药物对关键器官的特异性毒性与麻醉考量
心脏与血管系统风险
癌症与心血管疾病存在共同风险因素。化疗药物的毒性会进一步加剧心脏损伤。蒽环类药物(如多柔比星)与剂量依赖性心肌病相关,联合曲妥珠单抗治疗会增加心衰风险。铂类药物(如顺铂)可能引发心律失常和肾毒性,围术期需注意补液和限制造影剂使用。约20%接受奥沙利铂治疗的患者会出现严重的周围神经病变,麻醉中需防范压迫性损伤和低温加剧症状。
肺部并发症风险
博来霉素(常用于生殖细胞肿瘤)和免疫检查点抑制剂(如PD-1抑制剂)均可诱发肺炎。前者对高浓度氧疗敏感,后者需依赖类固醇治疗(发生率2-4%)。
内分泌系统影响
免疫治疗相关的内分泌毒性不容忽视。CTLA-4抑制剂(如伊匹木单抗)可引发垂体炎和甲状腺功能异常,PD-1抑制剂可能破坏胰岛β细胞导致糖尿病。麻醉前需筛查激素水平,术中警惕肾上腺危象风险,尤其对使用类固醇(如CHOP方案中的泼尼松)或免疫治疗的患者。
肾脏与其他考量
类固醇在SACT中广泛应用,但长期使用可诱发糖尿病和肾上腺抑制,麻醉管理需遵循补充方案。对于接受免疫治疗或靶向药物(如HER2/3抑制剂)的患者,需动态评估多器官功能。例如,顺铂给药后若出现急性肾损伤需延迟手术;紫杉烷类药物的微血管病变可能增加麻醉诱导期血流动力学波动的风险。
特殊药物的麻醉管理要点:博来霉素与贝伐单抗
博来霉素的肺毒性管理
博来霉素的肺毒性(肺炎至慢性纤维化)与氧自由基损伤有关,高浓度吸氧(FiO₂>0.3)可诱发致命性肺炎(死亡率2-10%)。高风险人群包括近期用药史、高累积剂量、吸烟及老年患者。麻醉管理需严格限制术中吸氧浓度(FiO₂≤0.3),优先考虑区域麻醉,避免液体过负荷。尽管有研究认为风险可能被高估,但临床仍需警惕(见下表总结)。对于需要此类药物的患者,了解其详细信息和潜在风险至关重要。
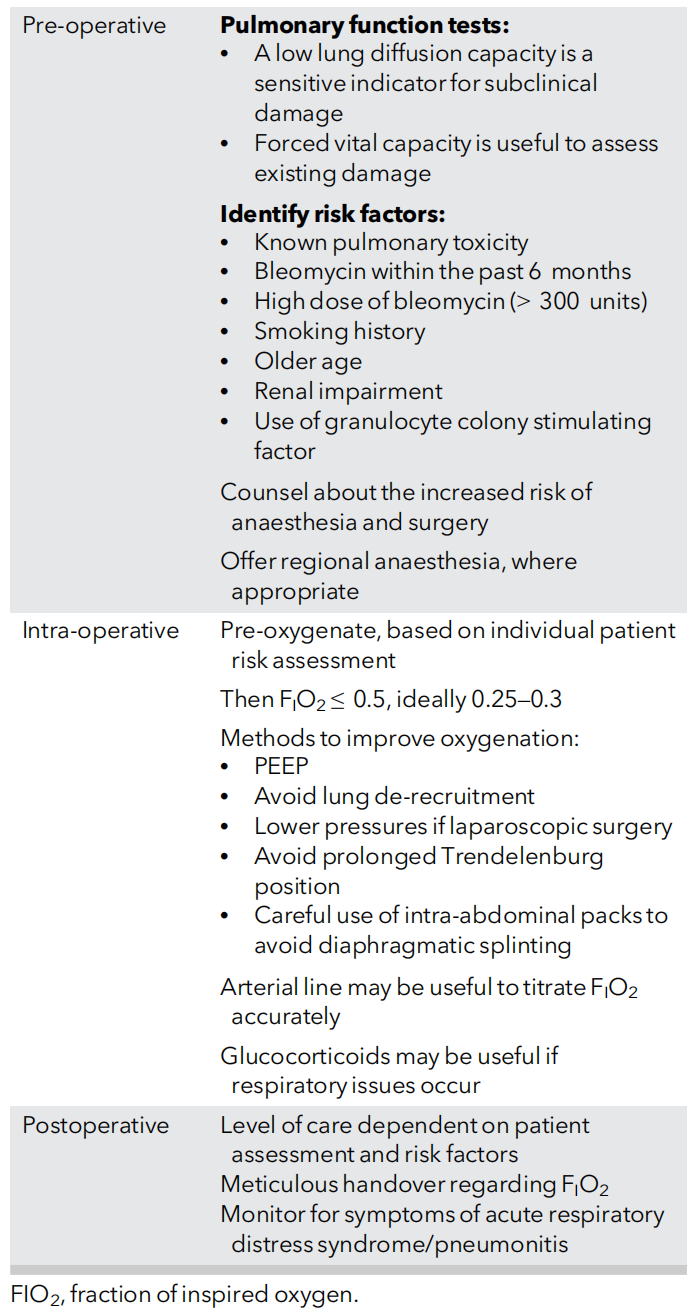
表4:暴露于博来霉素的患者护理中的重要注意事项总结。
贝伐单抗与伤口愈合风险
贝伐单抗(抗血管生成抗体)抑制伤口愈合,增加术后肠穿孔(1-2%)、坏死性筋膜炎和伤口裂开的风险。其半衰期约21天,择期手术需推迟至少4周。紧急手术需多学科评估。围术期管理重点包括术前筛查蛋白尿/高血压,术中减少组织牵拉,术后考虑延迟肠吻合或造瘘。确保贝伐单抗等药物的稳定供应对治疗计划的执行非常关键,患者可查询海外购药途径以备不时之需。
癌症患者紧急手术期间的麻醉注意事项
虽然多数SACT患者的手术是计划性的,但部分患者可能因SACT相关并发症(如肠穿孔、免疫治疗结肠炎、中性粒细胞减少性脓毒症)需要紧急手术。这些患者通常面临免疫抑制、内分泌紊乱和生理储备下降的挑战。手术不应因SACT而延迟。围术期需优先控制感染,加强术后监护,并与肿瘤团队协作评估SACT暂停风险及后续治疗调整。
血液管理方面,接受嘌呤类似物、CAR-T治疗或造血干细胞移植的患者需输注辐照血液,预防移植物抗宿主病。紧急情况下若无辐照血,应记录风险并密切观察。氨甲环酸可安全用于减少失血(如复杂卵巢癌手术)。
此外,需注意SACT相关毒性对手术的影响:近期(<7天)接受治疗者,术中体液需按细胞毒性污染处理;对类固醇依赖者,围术期需补充激素;警惕免疫治疗相关内分泌并发症。
需要手术处理的SACT相关并发症
化疗药物外渗发生率在0.01%至7%之间,严重时可致组织坏死,需紧急手术清创植皮。对于免疫受损患者,坏死组织易感染,治疗需优先安排。
结肠炎是免疫治疗的常见副作用(发生率5%-50%),严重时可致肠穿孔,需紧急手术。抗CTLA-4免疫治疗导致的最常见致死原因即为结肠炎。
癌症(尤其是血液系统恶性肿瘤,如白血病)是坏死性筋膜炎的危险因素。SACT相关的风险因素包括免疫抑制、糖尿病和贝伐单抗使用。
麻醉期间同步进行的抗癌治疗
一些局部抗癌治疗需要在麻醉下进行。电化学疗法通过电脉冲增强博来霉素或顺铂的疗效,用于皮肤肿瘤(如黑色素瘤、卡波西肉瘤),需全身麻醉和心电监测。肝动脉化疗栓塞术(TACE)通过栓塞剂联合化疗药(如阿霉素)治疗肝肿瘤,需镇静或全麻。
腹膜癌减瘤术联合腹腔热灌注化疗(HIPEC)是复杂的大型手术,在42°C下用化疗药灌注腹腔。麻醉管理需应对术中大出血、高热等挑战。术后镇痛常用硬膜外阻滞。铂类腹腔化疗时可静脉用硫代硫酸钠减轻肾毒性,但需警惕丝裂霉素C的肺毒性和顺铂的骨髓抑制风险。
总结:整合医学视角下的癌症患者围手术期管理
全身抗癌治疗(SACT)的进步深刻改变了围术期医学。免疫检查点抑制剂、抗体偶联药物等精准治疗在延长生存期的同时,也带来了延迟性器官毒性(心肌炎、肺炎、内分泌紊乱)和靶向药特异性损伤(如抗血管生成剂影响伤口愈合),重塑了麻醉风险评估体系。新辅助治疗后的功能状态需动态评估,特殊药物(如博来霉素、免疫治疗药物)暴露史要求制定个体化管理策略。
面对SACT的复杂毒性谱,麻醉管理需跨学科协作:平衡新辅助治疗窗口期的肿瘤控制与预康复需求;紧急手术需考虑免疫状态、药物代谢和血液制品特殊要求;术中SACT实施需防控多重风险。未来需要建立更好的毒性预警系统和围术期SACT连续管理路径,以实现肿瘤控制与手术安全的最佳平衡。若对治疗方案或副作用有疑问,可考虑使用AI问诊工具获取初步信息。
参考文献:
Weaver JMJ, Patey SJ. Systemic anti-cancer therapy and anaesthesia: a narrative review.Anaesthesia. 2025;80 Suppl 2:12-24. doi:10.1111/anae.16522