癌症治疗的曙光:探索表观遗传新靶点
癌症,一个让无数家庭为之忧心的疾病,特别是像非小细胞肺癌(NSCLC)、卵巢癌和胰腺癌这类恶性程度高、治疗难度大的肿瘤,更是让患者和家属们对新的治疗方法充满渴望。传统的化疗、放疗以及近年来的靶向治疗、免疫疗法,虽然取得了显著进展,但仍有许多患者面临耐药、副作用或无药可用的困境。因此,医学界从未停止对癌症治疗新策略的探索。近日,一项发表在国际顶级期刊《Nature Chemical Biology》上的突破性研究,为我们揭示了一种全新的抗癌思路,带来了令人振奋的希望。
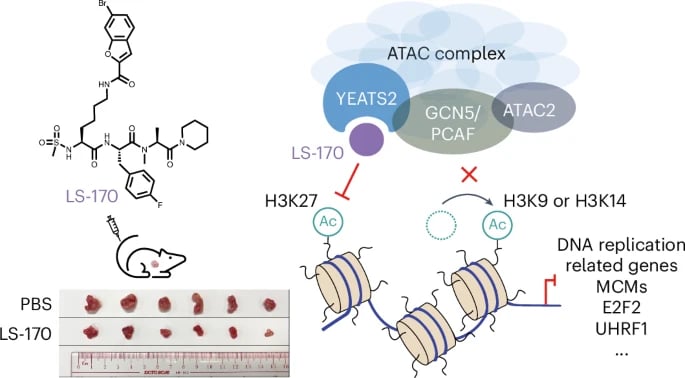
这项研究的焦点是一种名为“表观遗传”的生命现象,以及一个被研究人员成功驯服的关键细胞“开关操作员”——ATAC复合物。科学家们成功开发出一种首创的化学抑制剂,代号为LS-170,它能精准且选择性地靶向ATAC复合物,有望为多种癌症,特别是非小细胞肺癌,开辟一条全新的治疗途径。这意味着,我们或许能够从基因表达的源头,更精确地“关闭”癌细胞的生长和扩散。
揭秘癌细胞的“开关”:表观遗传与组蛋白乙酰化
DNA、组蛋白与“遗传开关”
要理解这项研究的突破性,我们首先需要了解癌细胞是如何“作恶”的。在我们身体的每一个细胞核中,都住着一套完整的遗传密码——DNA。这些长长的DNA链并非随意散布,而是精密地缠绕在一种叫做“组蛋白”的蛋白质结构上,形成我们肉眼看不见的“染色质”。你可以把DNA想象成一份详细的“生命说明书”,而组蛋白就像是这份说明书的“包装和索引”。
更有趣的是,这些组蛋白并非一成不变。它们身上可以发生各种化学修饰,就像一个个微小的“遗传开关”,精确控制着哪些基因应该被“开启”表达(即生产蛋白质,执行功能),哪些基因应该保持“沉默”。这些不改变DNA序列本身,却能影响基因表达的机制,就是我们常说的“表观遗传”。
关键的“开关操作员”——ATAC复合物
在众多的“遗传开关”中,组蛋白乙酰化是最重要的一种“开启”开关。它能让DNA和组蛋白的缠绕变得松散,从而让基因更容易被读取和表达。而负责执行这种乙酰化修饰的,是一类被称为“组蛋白乙酰转移酶”(HAT)的酶复合物。它们就像是细胞里的“电工”,负责接通和断开电路。
ATAC复合物就是这样一种非常重要的HAT复合物。在正常的细胞中,它在激活与细胞生长、DNA复制等关键生命活动相关的基因中起着至关重要的作用。然而,在癌症患者体内,情况却发生了变化。在非小细胞肺癌、卵巢癌、胰腺癌等多种肿瘤中,ATAC复合物变得异常活跃,它会错误地为许多“促癌基因”打开“开启”开关,助长癌细胞不受控制地生长和扩散,加速肿瘤的进展和转移。因此,找到一种方法,选择性地关闭这个过度活跃的“开关操作员”,一直是癌症治疗领域的一个重大挑战。
传统靶向策略的困境:为何精准如此艰难?
面对ATAC复合物在癌症中的“助纣为虐”,科学家们很早就尝试去抑制它。以往的药物开发工作,通常会选择靶向ATAC复合物内一个名为GCN5的催化亚基。GCN5是真正执行组蛋白乙酰化功能的“手”,直接阻断它似乎是个直接有效的办法。
然而,问题在于,GCN5并非只存在于ATAC复合物中。它还同时存在于细胞内其他几个同样重要的HAT复合物里,各自执行着正常的生理功能。这意味着,如果简单地去抑制GCN5,就像一把“大锤”敲下去,在关闭ATAC的同时,也会无差别地干扰其他正常的细胞功能,导致严重的副作用,甚至对健康细胞造成伤害。这种缺乏“特异性”和“选择性”的抑制,一直是表观遗传药物开发领域的一大瓶颈。
革命性突破:LS-170如何精准关闭癌基因?
独辟蹊径:靶向ATAC特有亚基YEATS2
为了解决传统靶向策略的困境,香港大学李祥教授团队与深圳湾实验室、清华大学的科研人员通力合作,设计出了一种极具创新性的策略:他们不再瞄准ATAC与其他HAT复合物共享的“通用部件”(GCN5),而是独辟蹊径,将靶点锁定在YEATS2这个蛋白质亚基上。YEATS2的独特之处在于,它是ATAC复合物所特有的,其他HAT复合物中并不存在。
利用先进的结构导向设计技术,研究人员精心开发出了一种强效且高度选择性的YEATS2抑制剂,也就是我们前面提到的LS-170。这项研究的精妙之处在于,通过靶向一个“独一无二”的部件,成功避开了对正常细胞功能的干扰。
精准作用机制:阻止ATAC锚定,关闭致癌基因
那么,LS-170究竟是如何发挥作用的呢?简单来说,LS-170能够特异性地结合到YEATS2的乙酰赖氨酸识别域上。这个识别域就像一个“抓手”,负责将ATAC复合物牢牢地锚定在染色质上,从而执行其开启基因的乙酰化功能。
当LS-170结合到YEATS2后,它就阻断了这个“抓手”的功能,使得ATAC复合物无法正常地附着到其靶基因组区域。就像是“开关操作员”失去了它连接电路的工具,自然也就无法打开那些致癌基因的“开关”了。

因此,在LS-170的作用下,局部组蛋白乙酰化水平显著减少,那些在非小细胞肺癌中被过度开启的致癌基因也随之被“关闭”。这是一种非常精准且高效的干预方式,能够从根源上切断癌细胞的生长信号。
LS-170展现的强大抗癌潜力
这项研究不仅仅停留在理论层面。在非小细胞肺癌的细胞系和动物模型中,LS-170展现出了令人惊喜的强效抗癌能力。实验结果表明,它能显著抑制肿瘤的生长和扩散,包括减少肿瘤体积和抑制癌细胞转移。
更值得注意的是,研究人员发现YEATS2基因在多种实体肿瘤中都存在扩增,这意味着它在这些癌症的发生发展中扮演着重要角色。除了肺癌,卵巢癌和胰腺癌也是YEATS2基因高表达的癌种。这一发现极大地拓展了LS-170及其这种靶向策略的潜在应用范围,预示着它可能不仅仅是肺癌的希望,未来也可能为其他多种癌症患者带来新的治疗选择。
这项研究的通讯作者李祥教授指出,这项工作不仅开发出了一种能够抑制肿瘤的强效且高度特异性的抑制剂,更重要的是,它开创了一种新颖的策略,即能够仅靶向多个共享相同酶核心的表观遗传复合物中的一个。这种“精准打击”的方法,为开发高度选择性、复合物特异性的药物开辟了激动人心的可能性,有望彻底改变未来人类疾病的治疗方法。
展望未来:癌症治疗新纪元与MedFind的承诺
这项针对ATAC复合物特有亚基YEATS2的抑制剂LS-170的发现,无疑是表观遗传药物发现领域的一个里程碑。它不仅解决了传统靶向策略的困境,提供了一种更精准、更安全的抗癌新工具,也为我们理解癌症的复杂机制提供了新的视角。尽管LS-170目前仍处于实验室研究阶段,距离真正应用于临床还需要漫长的药物研发和临床试验过程,但它所代表的创新理念和巨大潜力,已经足以点燃无数癌症患者心中的希望。
作为专注于癌症药物信息和患者服务的平台,MedFind将持续关注这类前沿研究的最新进展,致力于为广大癌症患者和家属提供最权威、最及时的抗癌资讯。我们深知每一份研究成果都承载着患者对生命的渴望。未来,如果像LS-170这样的创新药物能够成功上市,MedFind也将努力帮助患者了解其获取渠道,让全球最先进的抗癌技术惠及更多生命。
面对癌症,我们从不放弃希望。请持续关注MedFind,了解全球抗癌领域的最新突破,若您对现有治疗方案有疑问,或想了解更多已上市药物的信息,包括海外购药渠道,欢迎咨询MedFind的AI辅助问诊服务,或访问我们的官网,我们将竭诚为您服务,共同抗击病魔,迎接健康美好的未来。





