提到癌症,很多人会条件反射地皱眉,它往往与高风险、高死亡率、治疗复杂等词汇画上等号,似乎只与破坏和痛苦相关。然而,一篇发表在国际顶级期刊《Cell》上的重磅研究,却为我们揭示了一个颠覆认知的秘密:癌症,这种看似“十恶不赦”的疾病,竟然有可能在另一种同样令人恐惧的疾病——阿尔茨海默病(Alzheimer’s Disease,简称AD)面前,展现出意想不到的“保护作用”!这究竟是怎么一回事?难道“以毒攻毒”真的能成为现实?今天,MedFind将带您深入解读这项前沿研究,探索癌症与阿尔茨海默病之间那座隐藏的“桥梁”,以及它可能为无数患者家庭带来的希望。
第一章:阿尔茨海默病:无法回避的“记忆橡皮擦”
1.1 什么是阿尔茨海默病?——被“偷走”的记忆与自我
阿尔茨海默病,俗称“老年痴呆症”,是一种进行性发展的神经系统退行性疾病。它最显著的特征就是记忆力、思维能力和行为能力的逐渐衰退,最终严重影响日常生活。您可以想象,就像大脑中有一块无形的“橡皮擦”,每天都在一点点地擦去患者的记忆、思维和自我认知,直到他们变得连最亲近的人也无法辨认。这种疾病不仅对患者本人是巨大的折磨,对整个家庭来说,更是沉重的精神和经济负担。
1.2 阿尔茨海默病的严峻现状与现有治疗困境
随着全球人口老龄化加速,阿尔茨海默病的发病率正逐年攀升。据统计,全球每3秒钟就有一人被诊断出痴呆症,而阿尔茨海默病是最常见的痴呆症类型。目前,医学界尚未找到治愈阿尔茨海默病的方法,现有的药物也只能在一定程度上缓解症状或延缓疾病进程,但无法逆转病理损伤。这使得无数患者和家属生活在绝望之中,迫切期待着医学的突破和奇迹的出现。
1.3 大脑里的“垃圾场”:β-淀粉样蛋白与“清洁工”小胶质细胞
深入研究发现,阿尔茨海默病的关键病理特征之一,就是大脑中异常蛋白质——β-淀粉样蛋白(Aβ)的堆积。这些Aβ会形成毒性低聚物和斑块,像“垃圾”一样堵塞大脑神经细胞之间的通路,破坏神经元功能,导致记忆和认知功能下降。我们的大脑其实有一套强大的“自净系统”,其中最主要的“清洁工”就是小胶质细胞。它们是生活在大脑里的免疫细胞,负责巡逻、清除受损细胞和有害物质。在健康的大脑中,小胶质细胞能够有效地吞噬和清理β-淀粉样蛋白。然而,在阿尔茨海默病的进程中,这些小胶质细胞却常常“失灵”或变得“懒惰”,无法有效地完成它们的清理任务,导致“垃圾”越积越多,最终形成病变。
第二章:颠覆认知!癌症竟有“护脑神功”?
2.1 流行病学谜团:癌症患者与阿尔茨海默病的奇特关联
在深入探讨这项《Cell》研究之前,我们首先要提到一个长期以来困扰科学家的流行病学现象:许多研究数据显示,那些曾与癌症搏斗并幸存下来的患者,在晚年患上阿尔茨海默病的风险似乎要低于普通人群。这种反常的“保护效应”一度被认为是统计学上的巧合,或者是治疗癌症的药物对大脑产生了某种间接影响。但华中科技大学的研究团队认为,两者之间或许存在着某种更深层次、更直接的“隐藏交易”。

2.2 华中科技大学《Cell》重磅揭秘:肿瘤细胞分泌物的奥秘
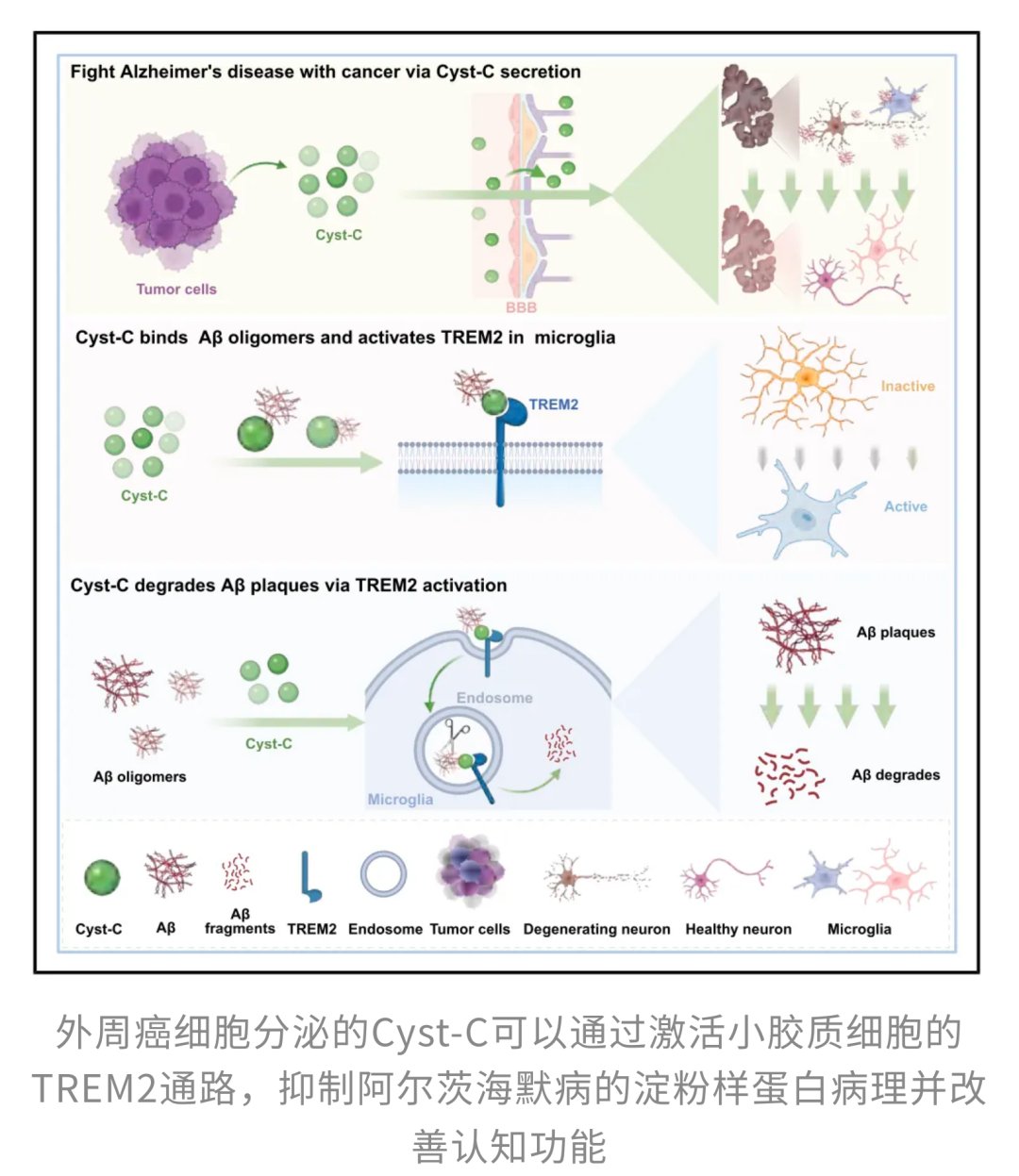
正是基于这一未解之谜,华中科技大学的研究团队展开了深入探索。他们的研究结果令人震惊:《Cell》论文指出,外周肿瘤细胞并非只是在体内“搞破坏”,它们还会分泌一种特殊的分子——半胱氨酸蛋白酶抑制剂-c(Cyst-C)。这种分子不仅能穿过大脑屏障,更重要的是,它能与具有毒性的β-淀粉样蛋白低聚物结合,并激活小胶质细胞表面的TREM2受体信号。这一系列“连锁反应”的启动,使得小胶质细胞清除淀粉样蛋白斑块的能力明显增强,大脑中异常蛋白的堆积速度随之减慢,阿尔茨海默病的病理进展得到有效抑制,患者的认知功能也随之改善。

2.3 锁定“护脑神功”的关键:Cyst-C的发现之旅
为了验证肿瘤的这种“护脑神功”并非偶然,研究团队进行了多项严谨的动物实验。他们将多种不同来源的外周肿瘤细胞移植到患有阿尔茨海默病模型的小鼠体内。令人惊喜的是,仅仅30天后,所有携带肿瘤的小鼠,其大脑中的β-淀粉样蛋白堆积速度都显著减缓,无论是Aβ₁–₄₂还是Aβ₁–₄₀的总水平都明显下降,大脑中的淀粉样斑块不仅数量减少,面积也显著缩小。这有力地证明了外周肿瘤的存在确实能够系统性地抑制阿尔茨海默病关键病理的形成与恶化。不过,研究也发现,这种保护作用是具有特异性的,它只对以β-淀粉样蛋白病变为主的阿尔茨海默病模型有效,对另一种以Tau蛋白病变为主的模型则“束手无策”。
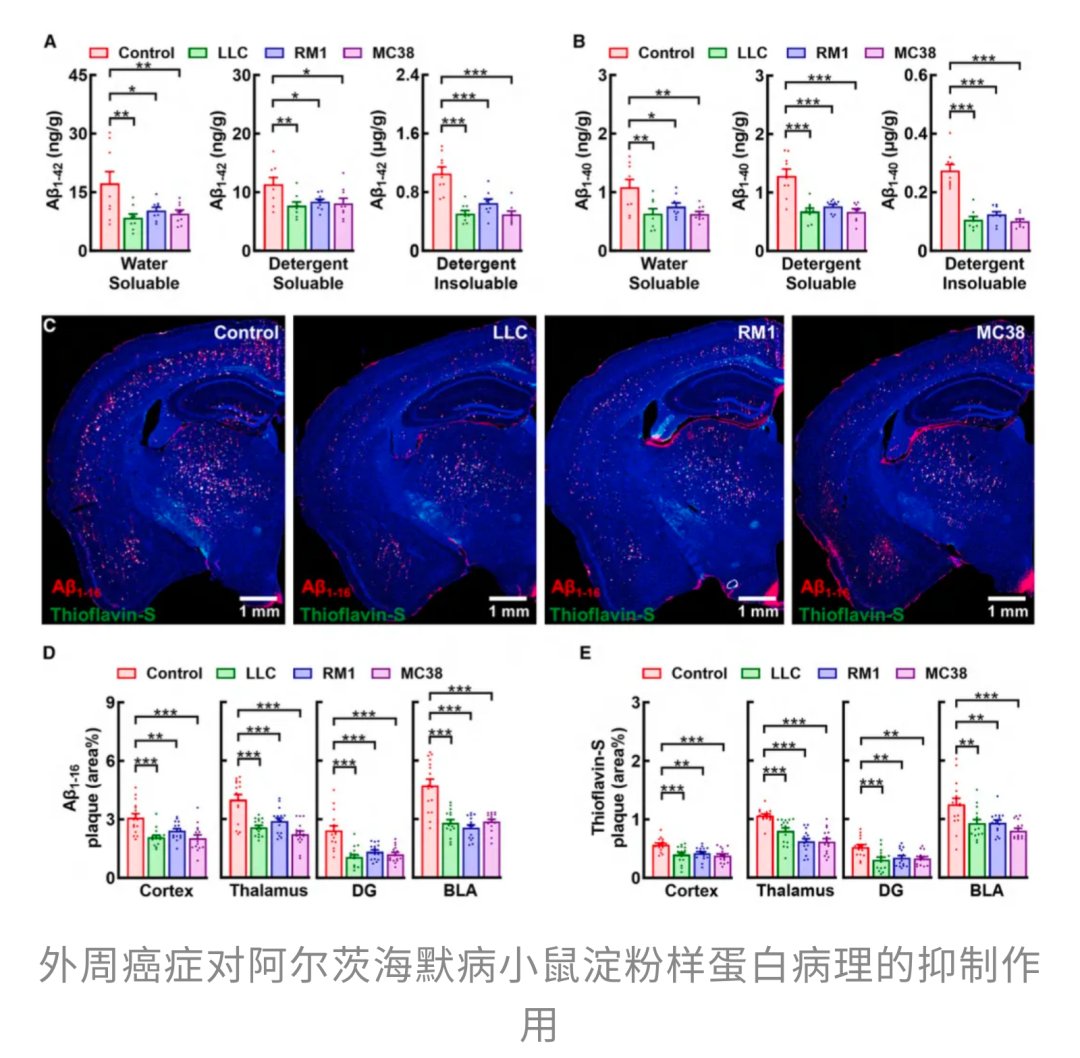
那么,肿瘤究竟是靠什么来施展这种“防痴呆神功”的呢?研究人员推测,很可能是肿瘤细胞分泌的某些物质,随着血液循环进入了大脑。为了验证这一猜想,他们收集了实验中三种不同来源肿瘤的分泌蛋白(CSPs),并每日注射到阿尔茨海默病模型小鼠体内。结果表明,仅仅依靠这些肿瘤分泌物,而无需接种任何癌细胞,就能够明显减少小鼠大脑中的淀粉样斑块,并显著改善它们的记忆能力。这说明,真正发挥作用的,并不是肿瘤本身,而是其释放的可溶性信号分子,这些分子好比一个“化学讯号包”,能够穿越血脑屏障,对大脑中的病理进程产生积极影响。
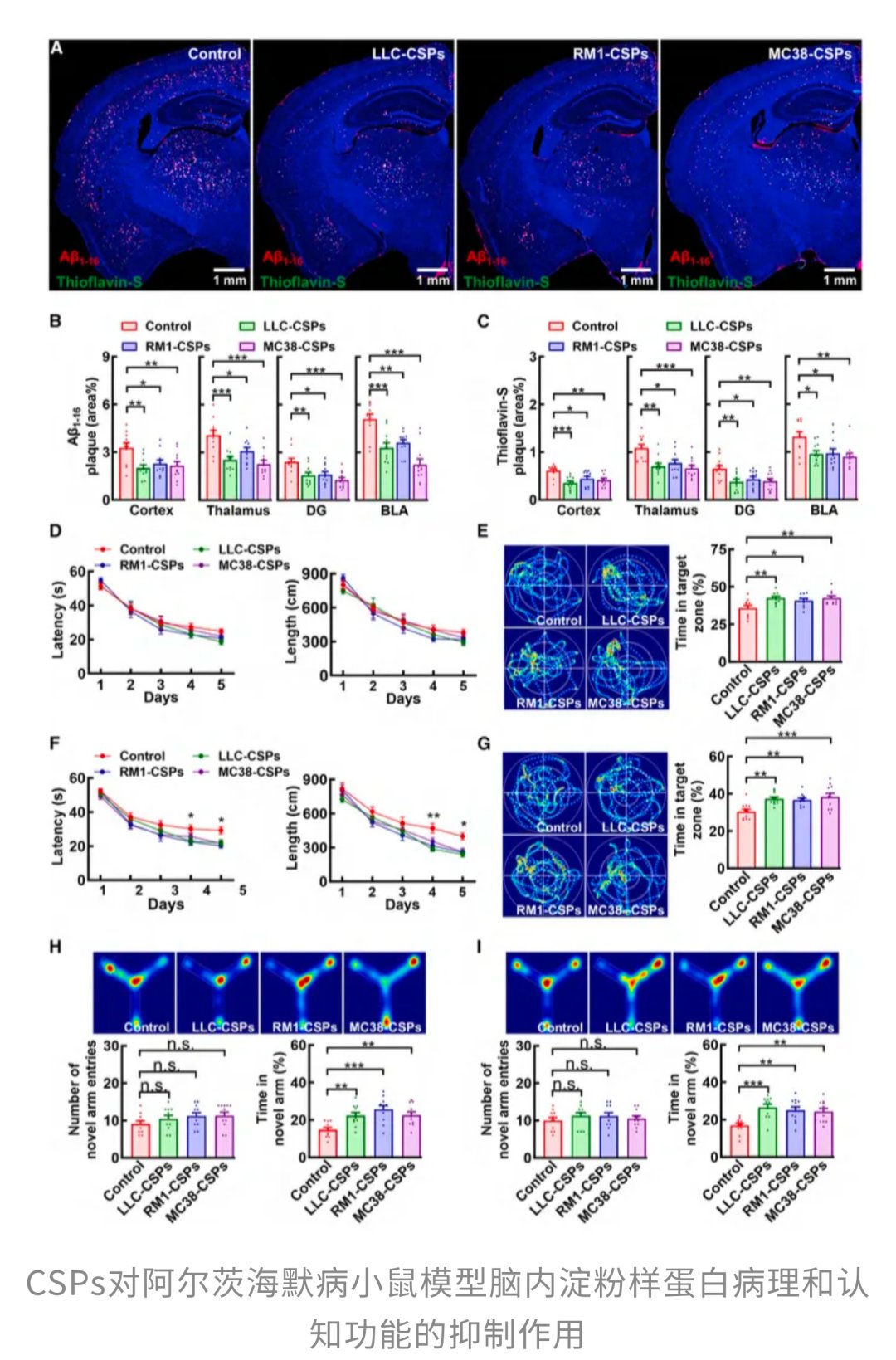
为了找出这个“化学讯号包”中的核心成分,研究团队对CSPs进行了蛋白质组学分析,从中筛选出四种可能与淀粉样斑块变化密切相关的“嫌疑蛋白”,其中就包括我们今天的主角——半胱氨酸蛋白酶抑制剂-c(Cyst-C)。通过基因敲除实验,他们发现,无论缺少其他哪种蛋白,肿瘤都能正常生长,但只有当编码Cyst-C的基因(Cst3)被敲除时,癌细胞那种“顺手帮大脑清理淀粉样斑块”的特殊能力才会彻底消失。这明确指出,Cyst-C是肿瘤发挥“护脑”作用的关键所在。

那么,如果单独将Cyst-C引入大脑,能否重现这种神奇的保护效果呢?研究人员将人源Cyst-C注射到阿尔茨海默病模型小鼠体内,奇迹发生了!Cyst-C不仅成功进入了大脑,还精准地定位并黏附在已有的淀粉样斑块上,导致小鼠大脑中的淀粉样斑块显著减少。随之而来的,是小鼠认知和记忆表现的明显改善。更令人兴奋的是,Cyst-C甚至重塑了大脑中的免疫生态,原本在斑块周围“观望”的微胶质细胞,在Cyst-C的处理后被明显“唤醒”,表现为斑块周围活化状态的CD68⁺微胶质细胞显著增多。这表明,Cyst-C并非单枪匹马对抗斑块,而是通过重新调动微胶质细胞的“清洁模式”,从免疫层面实实在在地改善了淀粉样病理。

第三章:Cyst-C如何“唤醒”大脑的自净系统?——“钥匙”与“锁”的完美配合
3.1 Cyst-C与β-淀粉样蛋白的结合:精准锁定“垃圾”
现在我们知道Cyst-C是关键,但它是如何具体发挥作用的呢?研究首先揭示了Cyst-C具有直接与β-淀粉样蛋白低聚物结合的能力。您可以想象,Aβ低聚物就像大脑中的“有害垃圾”,而Cyst-C则像一个专业的“识别和捆绑器”,能够精准地识别这些垃圾并将其包裹起来,从而降低它们的毒性,并为后续的清理工作做好准备。这种直接结合的能力是Cyst-C发挥作用的第一步,也是其高效清除淀粉样斑块的基础。
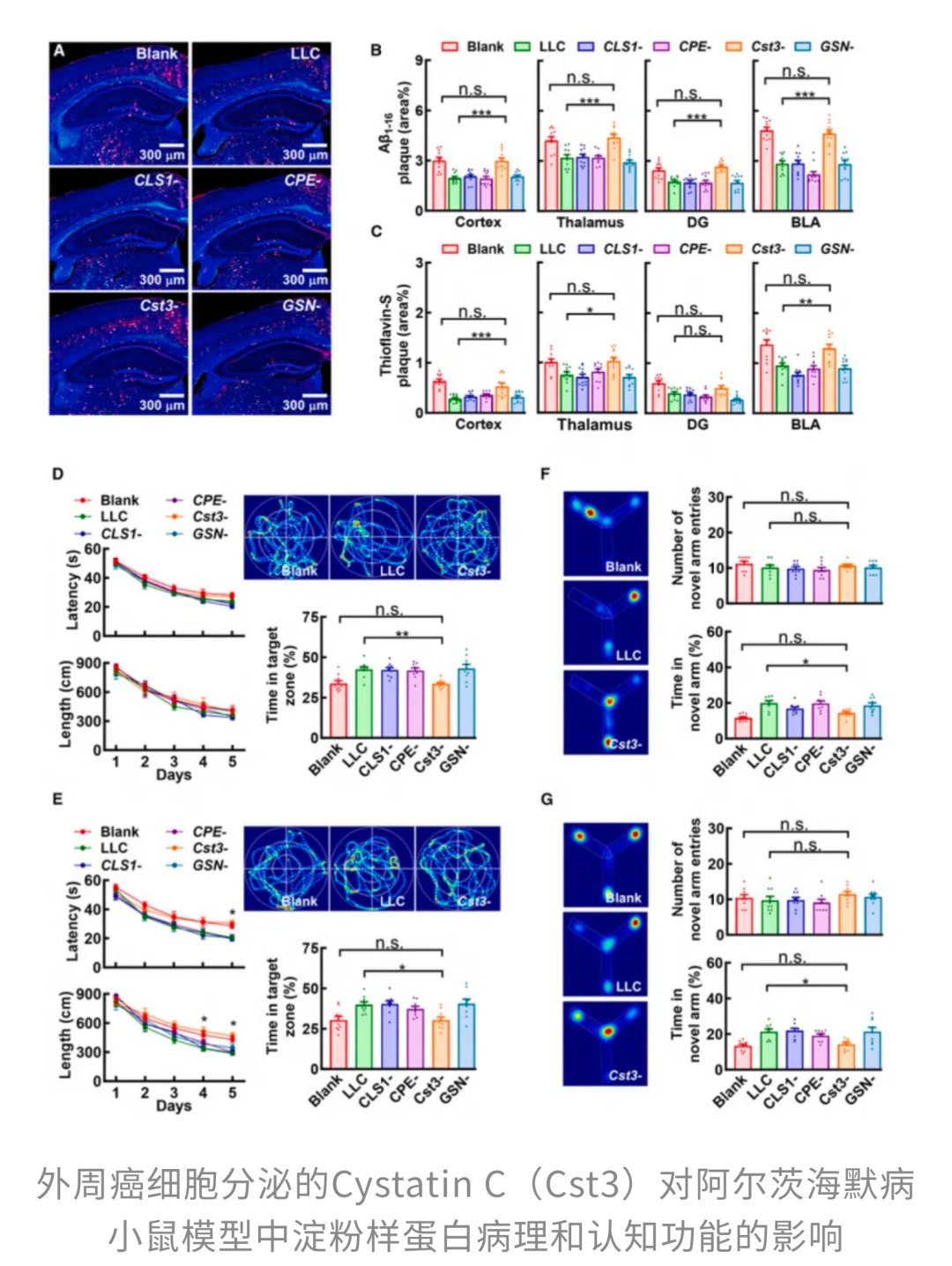
3.2 激活“清洁工”:TREM2受体信号通路的关键作用
光是捆绑住“垃圾”还不够,还需要有“清洁工”来搬走它们。这里就引出了第二个核心机制——TREM2受体。TREM2是小胶质细胞表面一个至关重要的“开关”或者说是“信号接收器”。在健康的大脑中,TREM2能够指挥小胶质细胞进行“巡逻”、感知并清除受损细胞和有害物质。然而,在阿尔茨海默病进程中,这个“开关”常常失灵,导致小胶质细胞对眼皮底下的Aβ斑块视而不见,从积极的“清洁工”变成了消极的“围观者”。
为了找到Cyst-C是如何“唤醒”这些“躺平”的免疫细胞的,研究人员在阿尔茨海默病小鼠的记忆中枢——海马体中,对人源Cyst-C的“交友圈”(即它所结合的蛋白复合物)进行了深入的蛋白质组学分析。这次“大筛查”精准地揪出了TREM2这个关键蛋白。研究发现,Cyst-C和TREM2能够直接结合。如果说Cyst-C是一把特制的“钥匙”,那么TREM2就是那把在阿尔茨海默病中生锈的“锁”。当Cyst-C这把“钥匙”精准插入并拧动TREM2这把“锁”时,它就激活了小胶质细胞内一系列下游磷酸化信号,从而“唤醒”了这些沉睡的“清洁工”。
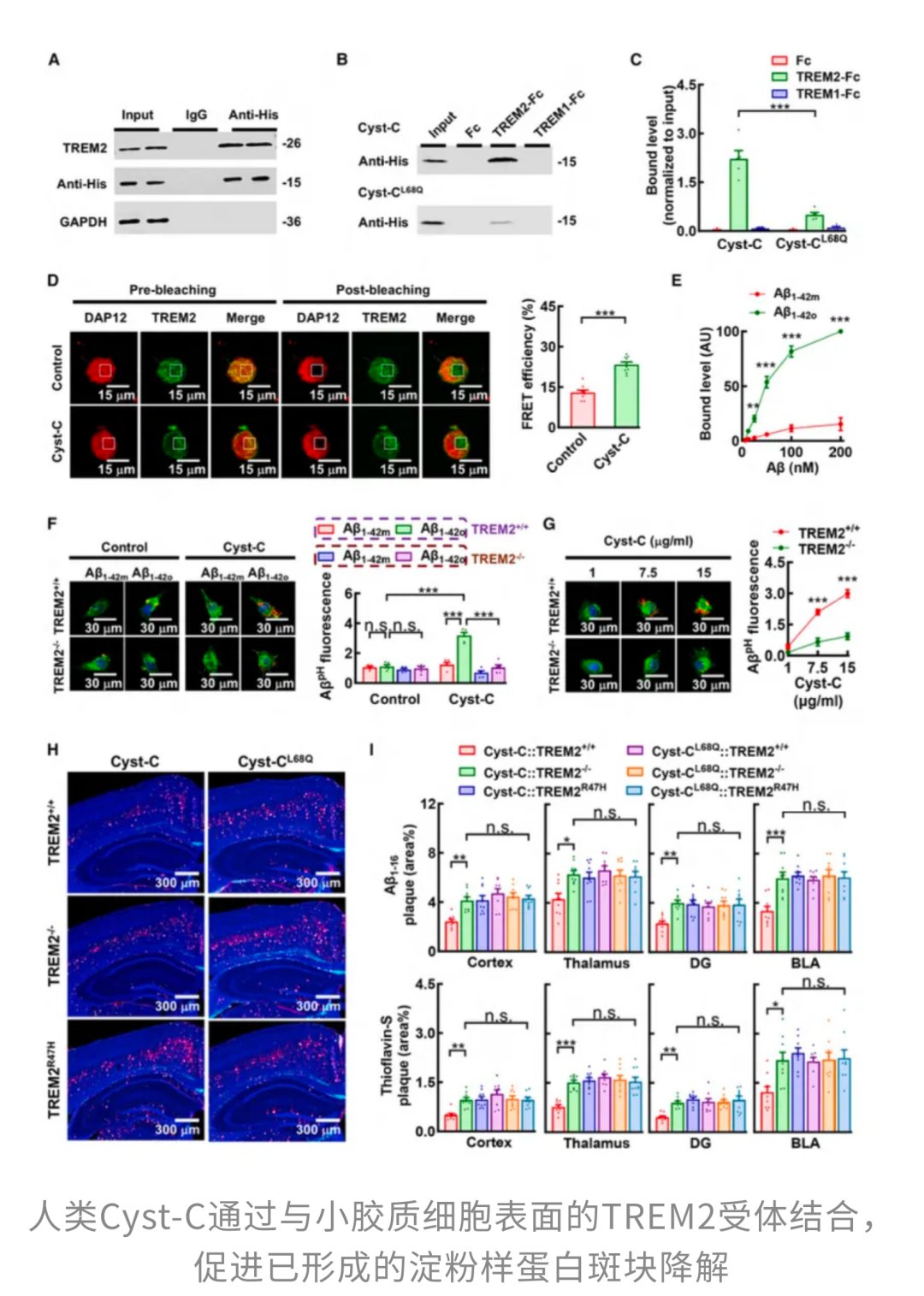
3.3 “清洁模式”启动:小胶质细胞的形态与功能转变
随着TREM2信号通路的启动,小胶质细胞迅速从静息状态转变为激活的CD68+状态。它们的形态和功能都发生了显著的巨变:小胶质细胞的胞体变得更大,原本细碎而复杂的分支逐渐收缩,整体形态逐渐转向典型的吞噬表型。这意味着它们不再是袖手旁观的“围观群众”,而是真正进入了“清理模式”,积极主动地去吞噬和降解那些有毒的β-淀粉样蛋白斑块。研究清楚地表明,这种免疫状态的转变与大脑中淀粉样斑块的减少高度同步,有力地证实了Cyst-C通过激活TREM2通路,成功地调动了大脑自身的免疫系统,从根本上改善了阿尔茨海默病的病理。
第四章:“以毒攻毒”的新解读:未来阿尔茨海默病治疗的曙光
4.1 颠覆传统:为神经退行性疾病治疗开辟新路径
这项华中科技大学发表于《Cell》的重磅研究,无疑为阿尔茨海默病的治疗思路带来了“换挡”的可能。在传统认知中,癌症意味着细胞无限增殖、刹不住车;而神经退行性疾病则代表神经细胞不断凋亡、日渐稀少。这两类看似毫无交集的疾病,通过Cyst-C和TREM2这条通路,在分子层面被意外地搭建起了一座“桥梁”。
此前,阿尔茨海默病的主流治疗策略大多围绕“源头管控”,试图减少β-淀粉样蛋白的生成或沉积,例如一些β分泌酶抑制剂或抗Aβ抗体。而这项研究则无疑展示了另一种极具潜力的新路径——“增强大脑自身清除淀粉样斑块的能力”。它将我们对疾病的理解从单一的“堵塞”扩展到“清理”,为我们打开了一扇全新的治疗大门。
4.2 从实验室到临床:Cyst-C的转化潜力与挑战
这项研究为“以毒攻毒”赋予了全新的科学注脚:我们不需要真的“引癌入脑”,而是可以从中提取出有益的分子,安全地利用它们来治疗疾病。未来,研究人员可以沿着这条线索,探索开发模拟Cyst-C功能的药物。这些药物可以设计成能够像Cyst-C一样,精准结合β-淀粉样蛋白,并激活小胶质细胞的TREM2受体,从而在不触发肿瘤的前提下,安全有效地唤醒大脑的“自我清洁”系统。
此外,开发直接靶向TREM2的激动剂(即能够激活TREM2的药物)也是一个非常有前景的方向。目前,国际上已有不少针对TREM2的药物研发项目正在进行中,这项研究无疑为这些项目的推进提供了更坚实的理论基础和更明确的靶点策略。通过增强小胶质细胞的清理功能,我们有望实现更早期、更有效的干预,甚至可能在疾病症状出现之前就阻止其发展,让“记忆橡皮擦”慢下来,甚至停下来。
当然,我们也要看到,这项研究目前主要基于小鼠模型,在人类中的普适性和安全性仍需进一步的验证。从实验室到临床应用,还有漫长的道路要走,包括药物的筛选、优化、临床试验的严格进行,以及对潜在副作用的全面评估等。但无论如何,这项研究都为阿尔茨海默病的治疗带来了前所未有的希望,让我们有理由期待一个更加光明的未来。
4.3 MedFind与您同行:关注前沿,探索更多可能
作为专注于癌症与重症患者服务的平台,MedFind始终致力于追踪全球最新的医学研究进展和治疗方案。我们深知,面对癌症、阿尔茨海默病这样的重疾,患者和家属往往充满焦虑与无助。因此,我们不仅分享权威的抗癌资讯、药物信息,更希望通过解读这类前沿突破,为患者带来希望和信心。
我们坚信,科学的进步是永无止境的。正是有了像华中科技大学这样的研究团队的努力,我们才能不断拓展对疾病的认知边界,为攻克疑难杂症提供更多可能性。MedFind将持续关注这些前沿研究的转化进展,希望能将最新的治疗理念和潜在方案,以最快、最安全的方式带到需要它们的患者身边。无论您是正在与疾病抗争,还是为家人寻找希望,MedFind都愿与您携手,共同探索医学的无限可能。
总而言之,这项关于Cyst-C和TREM2的突破性发现,为阿尔茨海默病的治疗开辟了全新的视野。它提醒我们,生命科学的复杂性远超想象,即使是“坏”的细胞,也可能蕴藏着“好”的秘密。希望在不久的将来,基于这项研究的创新疗法能够真正造福人类,帮助更多阿尔茨海默病患者重拾记忆,改善生活质量。





