引言:MTAP缺失——癌症治疗的新兴“脆弱点”
对于癌症患者而言,识别肿瘤细胞特有的“脆弱点”是实现精准治疗的关键。近年来,甲基硫代腺苷磷酸化酶(MTAP)基因缺失被确认为一个极具前景的泛癌种治疗靶点。MTAP缺失在多种实体瘤和血液系统恶性肿瘤中普遍存在,尤其在一些预后较差的癌症类型中发生率较高,如胶质母细胞瘤(GBM)和非小细胞肺癌(NSCLC)。
MTAP基因位于染色体9p21位点,该区域的缺失不仅是肿瘤进展的驱动因素之一,更重要的是,它为新型靶向疗法——特别是通过“合成致死”机制利用蛋白质精氨酸N-甲基转移酶5(PRMT5)抑制剂——提供了理论基础。本系统文献综述旨在全面总结MTAP缺失在不同癌症类型中的发生率、所使用的检测方法,以及它对患者预后(如总生存期,OS)的实际影响,帮助患者和家属更好地理解这一新兴生物标志物的临床价值,并关注相关的最新治疗方案与药物获取渠道。
一、MTAP基因缺失的生物学基础与治疗原理
1. MTAP基因的角色与9p21位点
MTAP基因编码一种关键的甲硫氨酸补救酶,在细胞代谢中发挥重要作用。它负责将5′-甲基硫代腺苷(MTA)转化为甲硫氨酸和腺嘌呤,维持细胞的正常运转。MTAP基因与另一个重要的肿瘤抑制基因——细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)——共同位于染色体9p21位点。由于位置邻近,MTAP缺失通常与CDKN2A的共缺失同时发生,这进一步证实了该基因组区域在肿瘤发生中的关键作用。
2. “合成致死”机制:MTAP与PRMT5抑制
MTAP缺失之所以成为一个有吸引力的治疗靶点,是因为它创造了一种“合成致死”的脆弱性。合成致死是指当两个基因同时失活时导致细胞死亡,而单独一个基因失活时细胞仍能存活的现象。
- MTAP缺失的后果: 当MTAP基因缺失时,MTAP酶的表达受损或消失,导致其代谢产物MTA在细胞内大量积累。
- PRMT5的抑制: 积累的MTA会部分抑制PRMT5。PRMT5是一种必需酶,参与许多与肿瘤活性相关的蛋白质的甲基化过程。
- 合成致死利用: 如果在MTAP缺失的肿瘤细胞中,进一步使用PRMT5抑制剂(如正在临床试验中的靶向药物),就能将PRMT5的活性降到细胞无法承受的水平,从而诱导癌细胞死亡,而对MTAP完整的正常细胞影响较小。
因此,MTAP缺失本身并非直接的致癌突变,而是肿瘤细胞在代谢上形成的一个致命弱点,为靶向治疗提供了精确打击的机会。
二、MTAP缺失在不同癌症类型中的发生率分析
MTAP缺失的发生率因癌症类型和检测方法而异。本系统综述分析了大量文献,总结了MTAP纯合缺失或蛋白质表达缺失在多种实体瘤和血液系统恶性肿瘤中的分布情况。
1. 发生率最高的癌症类型:胶质母细胞瘤(GBM)
在所有被研究的癌症中,GBM的MTAP缺失发生率最高,范围在26%至60%之间。值得注意的是,研究观察到地理差异:亚洲患者(尤其是日本)的MTAP缺失发生率最高(56%–60%),而欧洲、巴西和美国等地区的发生率相对较低(26%–48%)。GBM是一种高度恶性的脑肿瘤,高发生率意味着针对MTAP的靶向治疗对GBM患者具有巨大的临床潜力。
2. 常见实体瘤的发生率
- 非小细胞肺癌(NSCLC): 发生率范围为12%至38%。NSCLC的样本量最大,高达29,379名患者,表明MTAP缺失在肺癌中是一个重要的且普遍的生物标志物。
- 胰腺导管腺癌(PDAC): 发生率范围较广,为2%至64%。PDAC的样本量也很大(超过12,000名患者),提示MTAP缺失可能在胰腺癌的特定亚型中高度富集。
- 胆管癌: 发生率范围为15%至30%。
- 食管癌: 发生率范围为13%至27%。
- 胃癌: 发生率相对最低,范围为4%至14%。
- 头颈部鳞状细胞癌(HNSCC): 发生率范围为12%至62%,但由于研究使用的诊断方法不同,数据异质性较大。
3. 血液系统恶性肿瘤的发生率
在急性淋巴细胞白血病(ALL)患者中,MTAP缺失也较为常见。成人ALL患者的发生率为38%,儿童ALL患者的表达缺失范围为11%至41%。此外,弥漫性大B细胞淋巴瘤(DLBCL)的缺失发生率为5%。
三、MTAP缺失对癌症患者预后的影响
了解MTAP缺失的预后意义至关重要,因为它能帮助临床医生判断患者的疾病侵袭性,并指导治疗选择。研究结果表明,MTAP缺失在某些癌症中与更差的生存结局相关。
1. 胶质母细胞瘤(GBM)和非小细胞肺癌(NSCLC)
在GBM和NSCLC患者中,生存结局的报道最为集中,并且有证据表明MTAP缺失与不良预后相关:
- GBM: 在四项研究中,有两项明确指出MTAP表达缺失或纯合缺失与更差的总生存期(OS)相关(例如,一项研究的风险比HR=2.10,表明死亡风险增加一倍以上)。OS是指从诊断或治疗开始到死亡的时间。
- NSCLC: 一项研究报告低MTAP表达与更差的OS相关(HR=1.36)。另一项研究也显示低MTAP表达患者的生存期更差,并且无进展生存期(PFS)和中位生存时间(MST)也更短。PFS是指从治疗开始到疾病进展或死亡的时间。
这些结果提示,对于确诊为GBM或NSCLC且携带MTAP缺失的患者,可能需要更积极或创新的治疗策略。如果患者正在寻找针对这些高风险突变的最新国际治疗方案,可以通过 MedFind 国际药品代购与直邮服务 了解海外前沿药物的获取渠道。
2. 其他癌症类型
- ALL: 在成人和儿童ALL患者中,MTAP变异与更差的OS相关(HR=2.07)。
- 胆管癌和PDAC: 目前的研究信息有限,按MTAP状态划分的OS差异不显著。
总体而言,MTAP缺失似乎是许多恶性肿瘤的预后不良因素,尤其是在中枢神经系统肿瘤和肺癌中表现明显。
四、MTAP缺失的分子检测方法与标准化挑战
准确检测MTAP缺失是将其转化为临床实践的前提。然而,本综述指出,目前使用的分子实验室检测方法存在显著的异质性,这影响了发生率数据的统一性。
1. 主要检测方法
用于检测MTAP缺失或蛋白质表达缺失的方法多种多样,包括:
- 下一代测序(NGS): 这是最常见的检测类型,特别是基于FoundationOne等平台的NGS。NGS能够检测基因组的纯合缺失。
- 免疫组织化学(IHC): 用于检测MTAP蛋白质的表达水平。
- 阵列比较基因组杂交(aCGH)和单核苷酸多态性(SNP)阵列: 用于检测基因组拷贝数变异。
- 全外显子测序(WES)和聚合酶链反应(PCR)。
2. 标准化挑战
由于不同检测类型使用了不同的临界值和定义标准(例如,IHC评分多少才算“低表达”或“缺失”),导致研究之间报告的MTAP缺失发生率存在差异。例如,公共数据库如TCGA和AACR Genie报告的发生率有时与纳入文献的范围不一致。这种异质性强调了未来在临床诊断中需要建立标准化的MTAP诊断检测方法和拷贝数调用算法,以确保结果的可靠性和可比性。
对于需要进行全面基因组检测以寻找MTAP等罕见靶点的患者,了解不同检测平台的优劣至关重要。患者可以利用 MedFind AI 辅助问诊服务,获取关于基因检测报告解读和后续治疗方案的专业建议。
五、MTAP缺失患者的基因组特征与共突变模式
MTAP缺失很少单独存在,它通常与其他重要的基因组改变相关联,这对于制定联合治疗策略具有指导意义。
1. 与CDKN2A/B和KRAS的关联
- CDKN2A/B: 正如预期,在胆管癌、NSCLC、胃癌、PDAC和儿童ALL等多种癌症中,MTAP缺失与CDKN2A和CDKN2B高度相关。这三个基因的共缺失是9p21位点基因组不稳定的标志。
- KRAS: 在NSCLC、胆管癌、胃癌和PDAC患者中,MTAP缺失与更高的KRAS突变发生率存在统计学关联。KRAS突变本身是许多癌症中难以治疗的驱动基因,MTAP/KRAS共突变可能代表了一个预后更差、治疗更具挑战性的亚群。
2. MTAP状态与PD-L1表达的复杂关系
MTAP状态与免疫治疗的关键生物标志物PD-L1表达之间的关系较为复杂,并且因癌症类型而异:
- 在胆管癌中,MTAP表达缺失患者的PD-L1表达显著较低。
- 在PDAC中,MTAP表达缺失患者的PD-L1表达较高。
- 在NSCLC中,MTAP完整的患者报告了更高的PD-L1表达。
这种不一致性表明MTAP缺失对肿瘤免疫微环境的影响是多维度的,不能简单地将其视为免疫治疗的预测因子。临床医生在评估MTAP缺失患者是否适合免疫治疗时,需要结合具体的癌种和PD-L1检测结果进行综合判断。
六、针对MTAP缺失的未来治疗方向:PRMT5抑制剂的临床潜力
MTAP缺失作为一种新兴的合成致死靶点,正在驱动新药研发的浪潮。目前,针对MTAP缺失患者的PRMT5抑制剂正在积极进行临床试验评估。
1. PRMT5抑制剂的作用机制
PRMT5抑制剂旨在进一步降低MTAP缺失肿瘤细胞中PRMT5的活性,从而达到选择性杀伤癌细胞的目的。这类药物代表了一种高度精准的靶向治疗策略,有望克服传统化疗或放疗的局限性。
2. 临床试验的重要性
目前,许多携带MTAP缺失的实体瘤和血液系统恶性肿瘤患者(包括本综述中提到的GBM、NSCLC、PDAC等)正在被招募并纳入临床试验,以研究PRMT5抑制作为一种潜在的治疗策略。这些临床试验的结果将最终决定MTAP缺失是否能成为一个常规的临床治疗靶点。
对于患者而言,积极关注和参与相关的临床试验是获取前沿治疗机会的重要途径。同时,了解最新的临床研究进展和权威指南解读,能够帮助患者做出更明智的治疗决策。MedFind 致力于提供最新的药物信息、治疗方案解读、临床研究与指南资讯(点击查看),帮助患者掌握疾病的主动权。
七、总结与临床展望
本系统综述首次全面总结了关于MTAP缺失在多种实体瘤和血液系统恶性肿瘤中的现有证据。MTAP缺失或表达缺失在多种癌症中频繁发生,其发生率因肿瘤类型而异,在GBM中最高,在胃癌中最低。一些提示性证据表明,MTAP缺失可能与成人GBM、NSCLC和ALL患者的预后较差相关,这值得临床进一步深入调查。
MTAP缺失作为一种具有治疗潜力的生物标志物,其重要性日益凸显。鉴于其在抑制PRMT5这一关键肿瘤成分中的作用,MTAP缺失为药物治疗开发提供了一个有前景的靶点。未来需要进行更多针对不同人群的真实世界研究,以更好地了解MTAP缺失的预后意义,并克服当前文献中检测方法异质性的局限性。随着PRMT5抑制剂临床试验的推进,提高临床医生和患者对MTAP生物标志物的认识,将有助于识别出可能从这一新型靶向治疗中受益的患者群体。
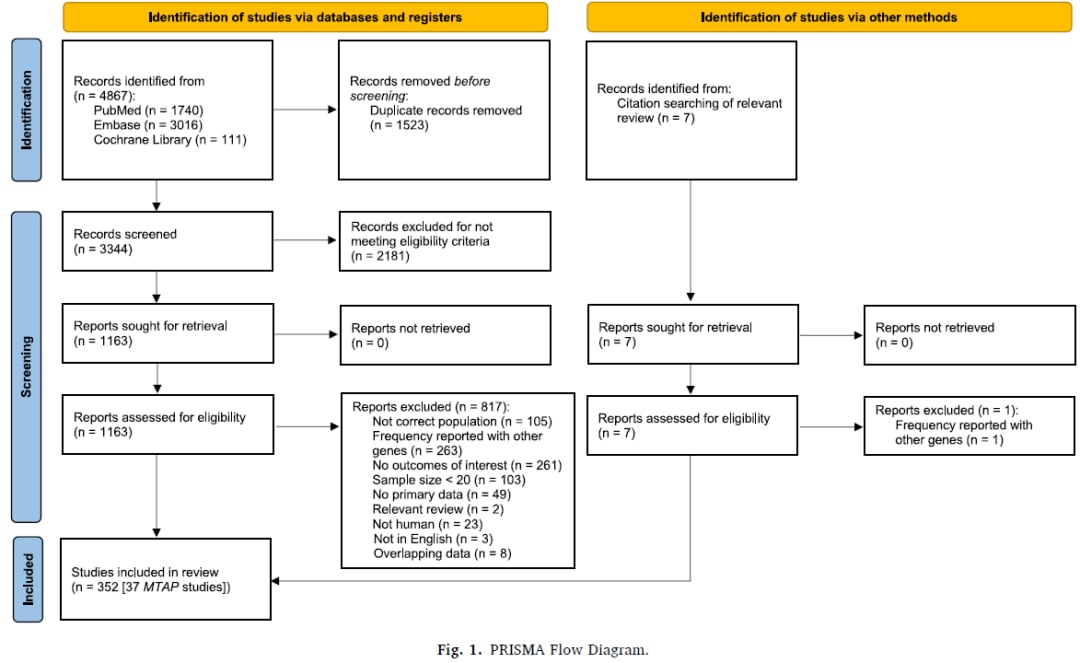
图1
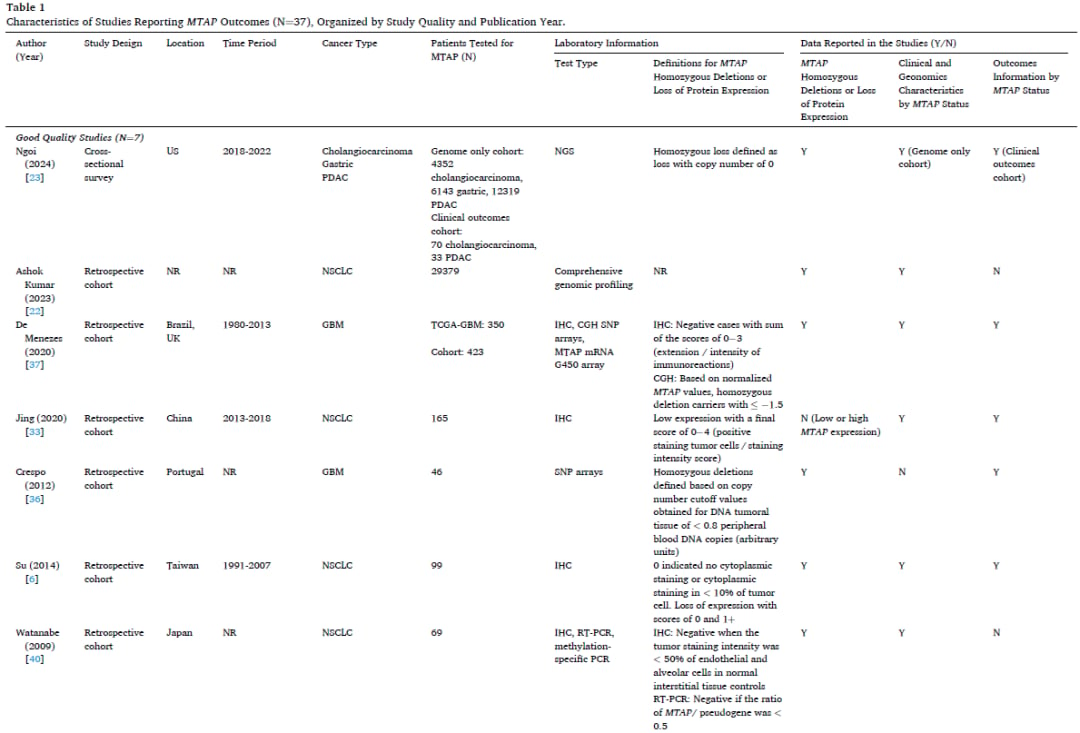
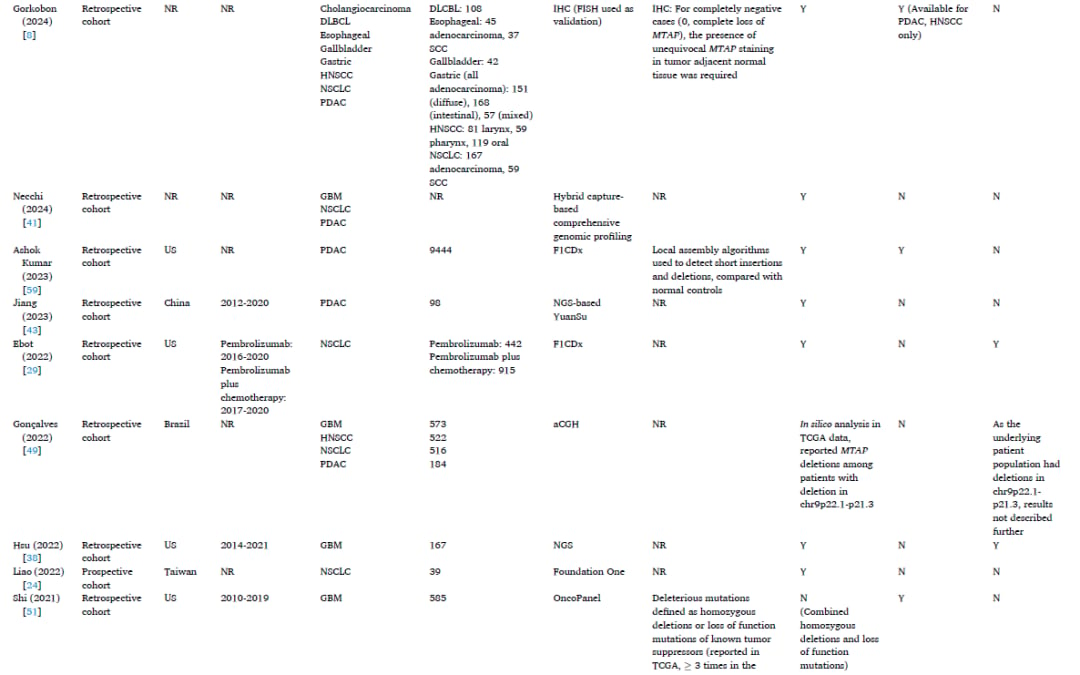

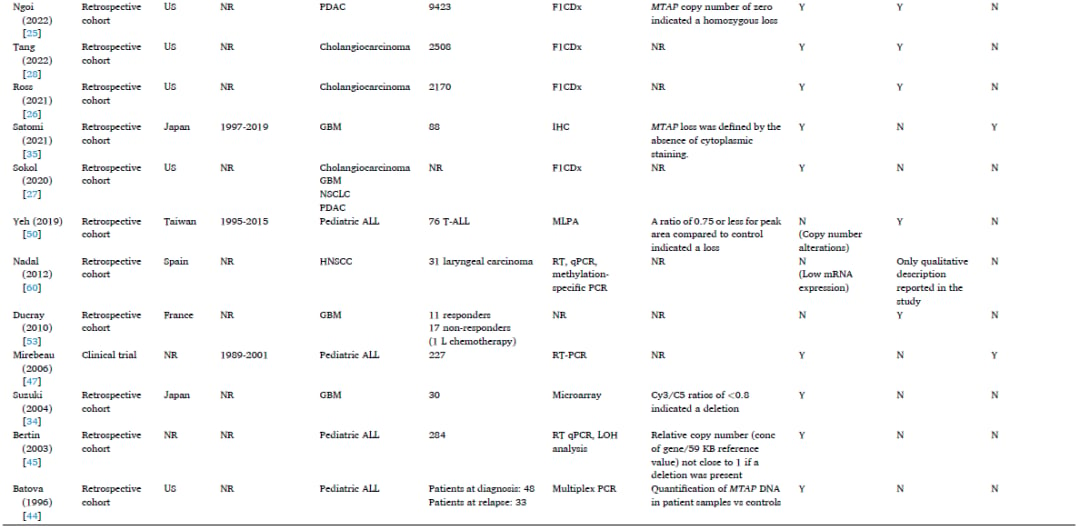
表1
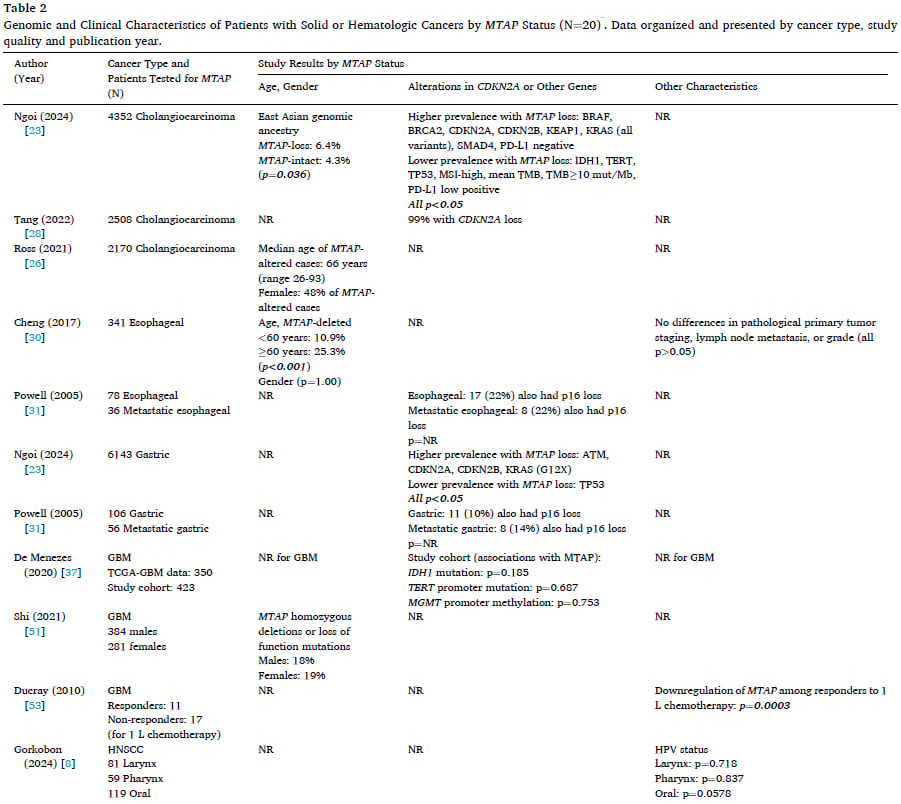

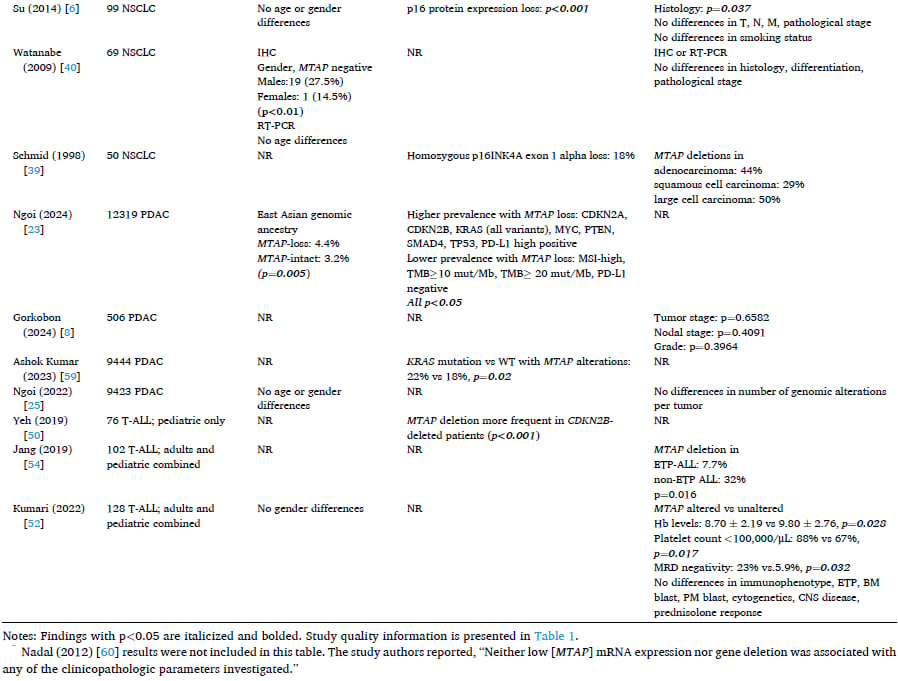
表2
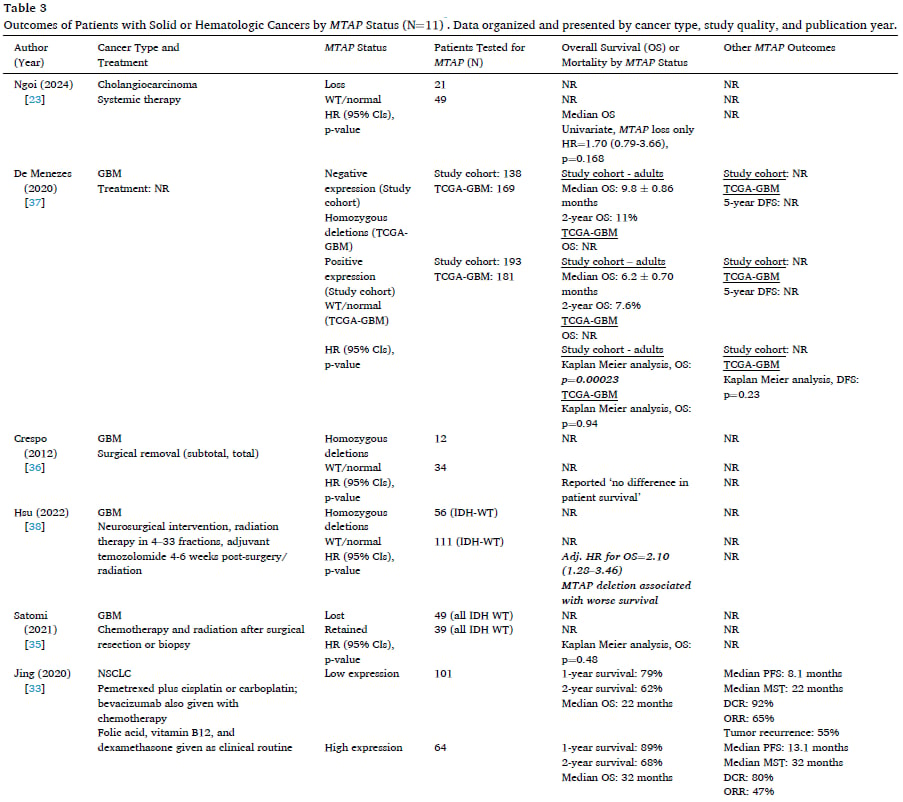
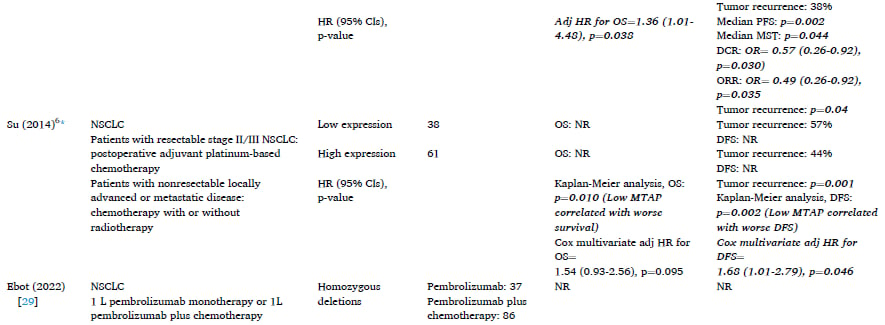
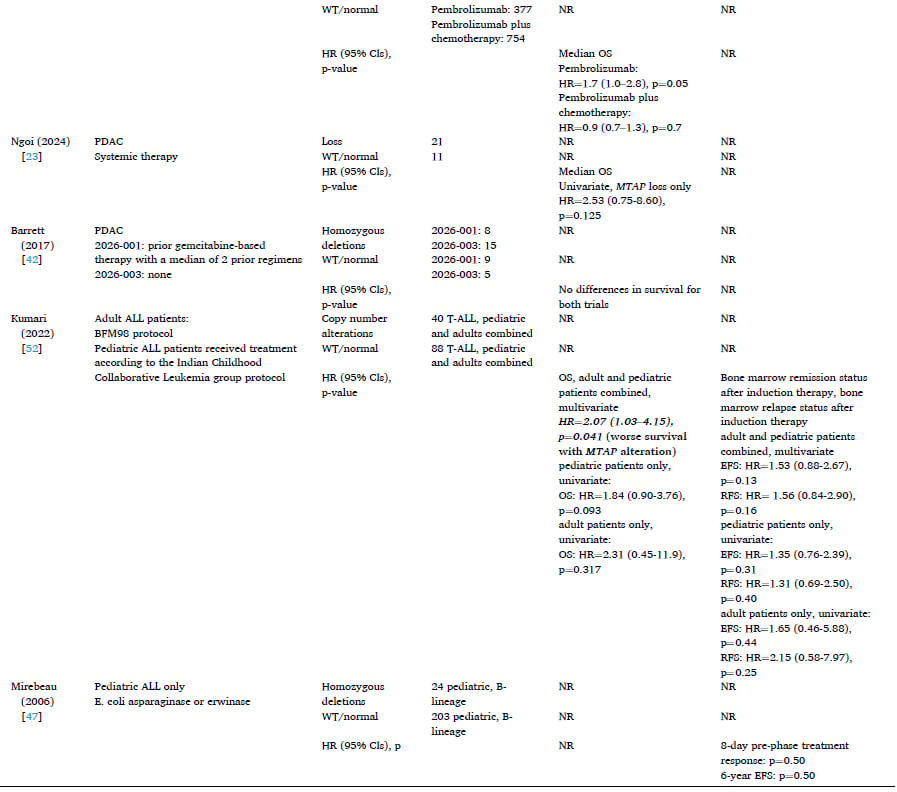
表3
使用的分子实验室检测类型:
文献证据收集了大量接受MTAP缺失或蛋白质表达缺失检测的患者样本。NSCLC的样本量最大,高达29,379名成人患者。PDAC的样本量第二大,高达12,319名成人患者。用于检测MTAP缺失或蛋白质表达缺失的分子实验室检测方法多种多样,包括阵列比较基因组杂交(aCGH)、下一代测序(NGS)或基于NGS的平台、微阵列、单核苷酸多态性(SNP)阵列、聚合酶链反应(PCR)平台、免疫组织化学(IHC)和全外显子测序。最常见的检测类型是使用FoundationOne平台的NGS,有7项研究(24%,7/29项)报告了MTAP缺失结果。定义MTAP缺失或蛋白质表达缺失的实验室标准因检测类型而异,具有不同的临界值。
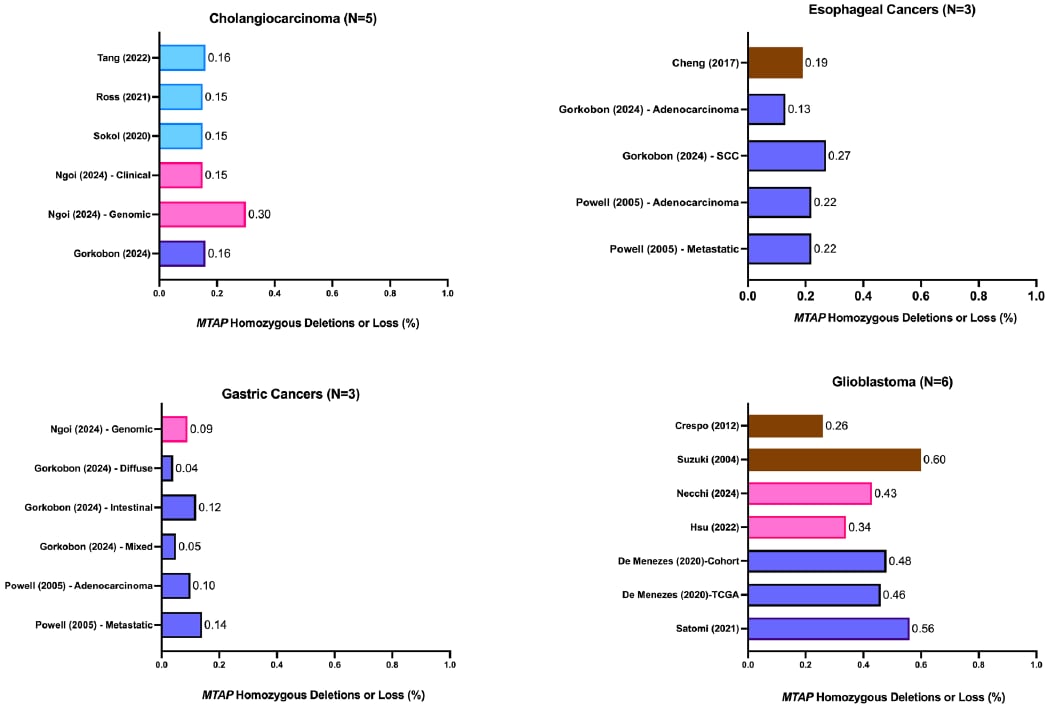
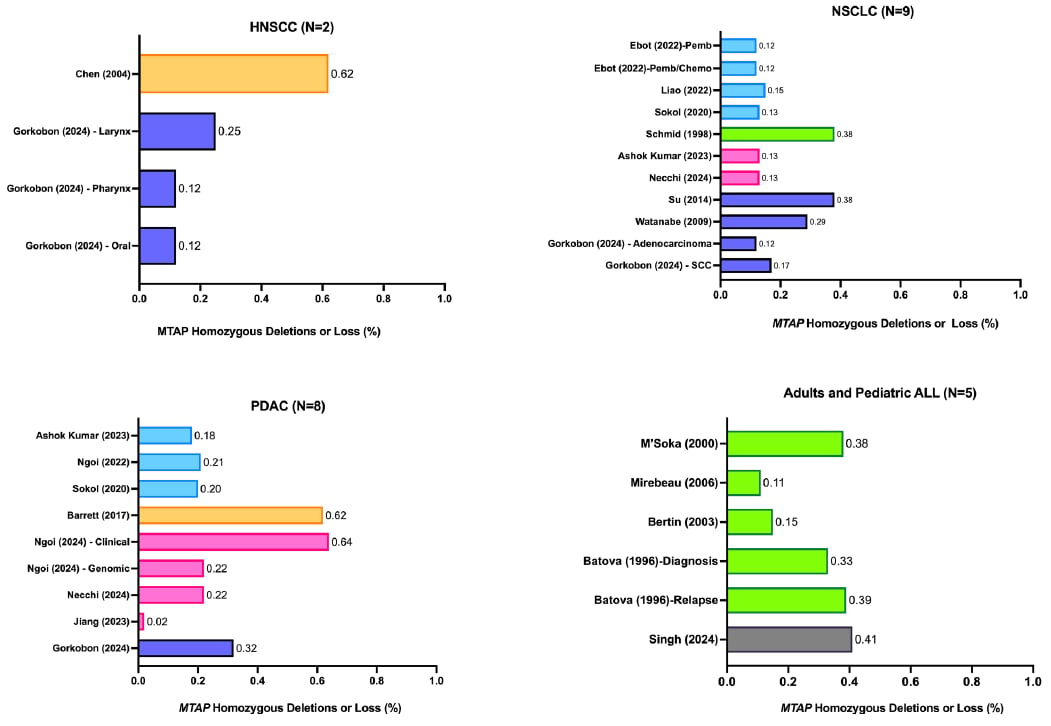

图2