肝细胞癌(HCC)的分子驱动力:CTNNB1突变与WNT通路
肝细胞癌(HCC)是全球范围内常见的恶性肿瘤之一,尤其在亚洲地区发病率较高。对于晚期HCC患者而言,了解肿瘤背后的分子机制是选择精准治疗方案的关键。近期,一项发表在《自然》(Nature)杂志上的重磅研究,深入揭示了HCC中一个重要的致癌驱动因素——β-连环蛋白(β-catenin)突变,如何与肝脏自身的结构特性相互作用,共同决定肿瘤的发生和发展。这项研究不仅为我们理解HCC的复杂性提供了新的视角,更重要的是,它指明了针对CTNNB1突变型肝细胞癌的潜在治疗靶点,特别是mTOR信号通路,为患者带来了新的希望。
在许多表型正常的组织中,致癌突变其实并不少见。这表明,肿瘤的发生往往需要多个事件的汇聚,并且许多正常的组织过程,例如组织分化,可能会阻止癌变。在肝脏稳态过程中,WNT-β-连环蛋白信号传导对于维持肝脏的区域分化至关重要。然而,编码β-连环蛋白的CTNNB1癌基因在肝细胞癌中却经常发生突变,导致WNT信号传导异常激活,从而促进细胞的失控生长。
什么是肝细胞癌(HCC)?
肝细胞癌是原发性肝癌中最常见的类型,通常发生在慢性肝炎(如乙肝、丙肝)或肝硬化的背景下。HCC的治疗方案复杂多样,包括手术切除、肝移植、局部消融、介入治疗、系统性靶向治疗和免疫治疗等。随着分子生物学的发展,精准医疗要求我们识别驱动肿瘤的关键基因突变,以便选择最有效的靶向药物。
β-连环蛋白(CTNNB1)突变在HCC中的地位
在HCC患者中,CTNNB1基因突变率高达15%至30%,是仅次于TP53的第二大常见突变。这种突变通常发生在CTNNB1基因的第3外显子,导致β-连环蛋白无法被正常的降解复合体识别和破坏。结果是,大量的β-连环蛋白在细胞质和细胞核内积累,持续激活WNT靶基因,促进细胞增殖。CTNNB1突变型HCC通常具有独特的临床病理特征,例如较高的分化程度和较低的炎症反应,但对传统的治疗方法(如索拉非尼)的反应可能不如其他分子亚型。
WNT-β-连环蛋白信号通路基础解析
WNT信号通路是调控细胞增殖、分化、迁移和凋亡的关键通路。在正常细胞中,如果WNT信号不活跃,β-连环蛋白会被降解复合体(包括APC、AXIN等蛋白)磷酸化并标记,随后被蛋白酶体降解。当WNT信号激活或CTNNB1发生突变时,降解复合体失活,β-连环蛋白得以稳定并进入细胞核,与Tcf/Lef转录因子结合,启动下游基因(如MYC、Cyclin D1)的表达,从而驱动细胞生长和增殖。了解这一机制,是理解本次Nature研究结论的基础。
Nature重磅研究:肝脏区域化如何决定肿瘤潜力?
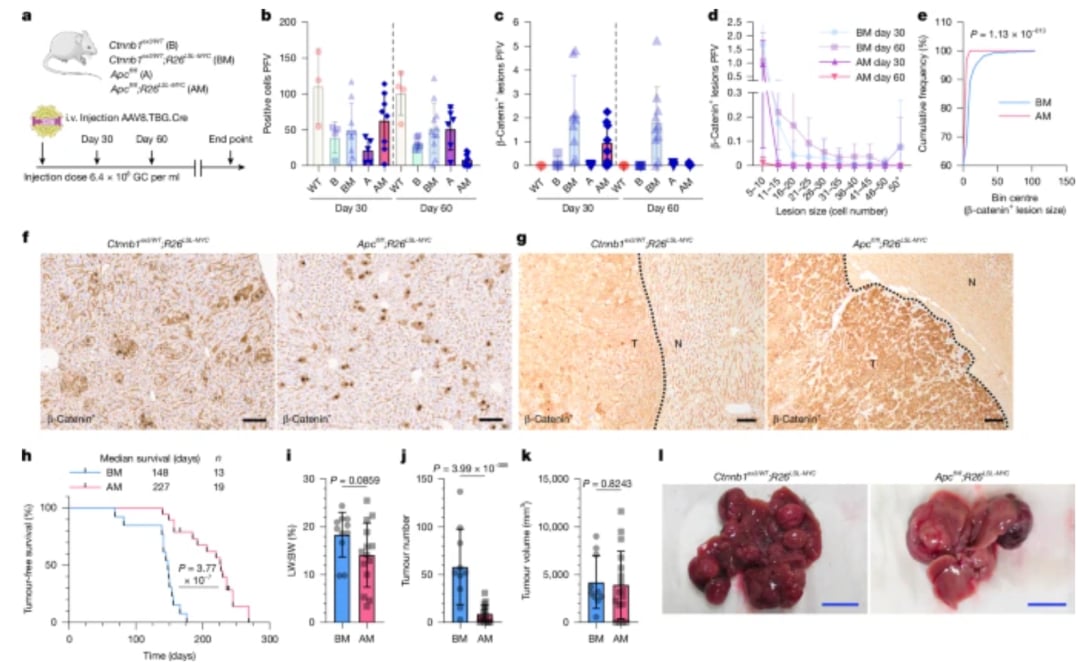
2025年11月19日,英国格拉斯哥大学Owen J. Sansom团队在《自然》(Nature)在线发表了题为《肝脏区域化决定突变β-连环蛋白的致瘤潜力》(Hepatic zonation determines tumorigenic potential of mutant β-catenin)的研究论文。该研究的核心在于检测了在肝肿瘤发生过程中,WNT驱动的带状肝细胞群生长和分化之间的拮抗相互作用。
研究提出一个关键观点:区域特性决定了肝细胞对WNT驱动的肿瘤发生的易感性,而逃避WNT诱导的分化对肝癌至关重要。
肝脏的“分区管理”:肝小叶区域化(Hepatic Zonation)
在稳态环境下,大多数肝细胞处于静止状态。肝脏小叶是肝脏的基本功能单位,它沿着门静脉结到中央静脉的轴线被划分为不同的区域,即肝脏区域化(Hepatic Zonation)。这种分区使得不同区域的肝细胞执行不同的代谢功能。
WNT通路活性梯度下降是肝分区的主要调节因子:
- 1区(门脉周围):靠近门静脉,氧气和营养物质丰富,WNT通路活性最低。
- 3区(中心周围):靠近中央静脉,氧气和营养物质相对较少,WNT通路活性最高。
这种结构将核内β-连环蛋白的活性限制在中心周围3区肝细胞,从而驱动它们的成熟并区隔化WNT靶基因的表达。简而言之,在正常情况下,WNT信号在3区的作用是驱动细胞成熟和分化,而非单纯的增殖。

区域特性与WNT信号梯度的关系
研究人员发现,尽管CTNNB1突变在整个肝脏中都可能发生,但只有特定区域的肝细胞才更容易发展成肿瘤。这与再生和肝细胞癌(HCC)过程中WNT通路活性驱动肝细胞生长的现象形成了对比。
进一步使我们对WNT驱动的HCC的理解复杂化的是,CTNNB1外显子3点突变的选择性高于其他类型的WNT通路激活突变(如APC截断或RNF43/ZNRF3丢失),尽管这些突变在小鼠模型中已被证明是致瘤性的。了解CTNNB1突变如何促进肿瘤发生和改变区域规范至关重要,因为先前的谱系追踪研究已经证明了在稳态肝脏和HCC起源细胞中肝细胞生长的区域差异。
为什么3区肝细胞对WNT诱导的肿瘤发生具有“难治性”?
研究指出,具有强烈WNT通路激活的中心周围(AM)肝细胞,其致瘤性反而较低。
具体来说,GLUL和lgr5阳性的3区肝细胞亚群对WNT诱导和MYC诱导的肿瘤发生具有“难治性”(refractory)。这是因为在稳态环境下,WNT信号在3区的作用是驱动细胞成熟和分化,这种分化状态会抑制突变带来的增殖信号。当肝细胞分化到极端的3区命运时,这种分化过程会抑制由β-catenin突变和外源性MYC表达合作驱动的“增殖翻译体”(proliferative translatome)。
肿瘤发生的关键机制:逃避分化与增殖翻译体
如果肝细胞的区域特性能够抑制肿瘤发生,那么肿瘤细胞是如何突破这一屏障的呢?研究人员通过在肝小叶中零星激活突变的CTNNB1和MYC等位基因,观察到了肿瘤发生的关键转变。
CTNNB1突变如何与MYC协同作用
研究发现,β-catenin突变需要与外源性MYC表达合作,才能有效地驱动增殖翻译体。MYC是一种强大的致癌基因,它与WNT通路协同作用,能够极大地增强细胞的增殖能力。然而,即使有了这两个强大的致癌驱动力,如果肝细胞保持在高度分化的3区状态,增殖仍然受到抑制。
逃避WNT诱导分化:肿瘤细胞的生存策略
只有当突变的肝细胞成功逃脱了WNT通路在3区驱动的正常分化程序时,它们才能转变为增殖性病变。这些早期病变的特征是:
- WNT通路激活减少: 相对于正常的3区细胞,增殖性病变中的WNT通路激活程度反而有所降低。
- MAPK信号升高: 丝裂原活化蛋白激酶(MAPK)信号通路的活性显著升高。研究认为,MAPK信号的升高是抑制3区分化的关键步骤。
因此,肿瘤细胞的生存策略并非是简单地最大化WNT信号,而是通过逃避WNT诱导的分化,将WNT信号的能量转化为不受约束的增殖能力。
发现新的治疗靶点:IGFBP2-mTOR-Cyclin D1通路
这项研究最重要的临床价值在于,它明确识别了驱动这些增殖性病变的关键下游信号通路:IGFBP2-mTOR-Cyclin D1通路。
mTOR通路在CTNNB1突变型HCC中的核心地位
哺乳动物雷帕霉素靶蛋白(mTOR)是细胞生长、增殖、代谢和存活的关键调节器。mTOR信号通路的异常激活是许多癌症的共同特征。
研究发现,这些增殖性病变高度依赖于IGFBP2-mTOR-Cyclin D1这条通路。IGFBP2(胰岛素样生长因子结合蛋白2)是上游信号,它激活mTOR,进而驱动Cyclin D1的表达,Cyclin D1是细胞周期中的关键蛋白,促进细胞从G1期进入S期,实现增殖。
更令人振奋的是,研究人员通过实验证明,无论是抑制IGFBP2还是直接抑制mTOR,均能有效抑制细胞增殖和肿瘤发生。这为CTNNB1突变型HCC的治疗提供了明确的、可操作的靶点。
mTOR抑制剂在肝癌治疗中的潜力与挑战
基于这项研究的发现,mTOR抑制剂有望成为针对CTNNB1突变型HCC的有效治疗选择。虽然mTOR抑制剂如依维莫司(Everolimus)在肾细胞癌、神经内分泌肿瘤等领域应用广泛,但在HCC中的地位一直相对有限,主要用于二线治疗或特定亚型。
然而,如果患者被确诊为CTNNB1突变型HCC,并且肿瘤的增殖依赖于mTOR通路,那么针对性的mTOR抑制剂治疗可能会带来显著的临床益处。这要求临床医生在制定治疗方案前,必须进行详细的基因检测,确认CTNNB1突变状态和mTOR通路的激活情况。
患者如果需要了解更多关于mTOR抑制剂在肝癌中的应用、疗效数据以及海外获取渠道,可以访问 MedFind 平台,获取最新的药物信息和代购直邮服务。
mTOR抑制剂的临床应用回顾
mTOR抑制剂的历史可以追溯到雷帕霉素(Rapamycin),它通过抑制mTORC1复合体发挥作用。在肝癌领域,依维莫司(Everolimus)曾被研究用于索拉非尼治疗失败后的二线治疗。尽管在整体人群中效果不尽理想,但本次Nature研究提示我们,mTOR抑制剂的疗效可能被特定的分子亚型(即CTNNB1突变型)所隐藏。
未来的临床试验应着重于筛选CTNNB1突变阳性且mTOR通路高表达的HCC患者,以验证mTOR抑制剂或其联合疗法在这一特定人群中的疗效。这代表了从广谱治疗向高度精准治疗迈进的重要一步。
临床意义与未来展望:如何针对CTNNB1突变型HCC?
这项研究的发现具有深远的临床意义。它不仅解释了为什么某些肝细胞对致癌突变具有抵抗力,更重要的是,它为CTNNB1突变型HCC的精准治疗提供了新的分子基础。
靶向CTNNB1突变型HCC的现有策略
目前,针对CTNNB1突变本身尚无直接的靶向药物获批。因此,临床上主要采用以下策略:
- 多靶点抑制剂: 如仑伐替尼(Lenvatinib)或索拉非尼(Sorafenib),它们通过抑制多种激酶(包括血管生成和增殖相关通路)来发挥作用。
- 免疫检查点抑制剂: CTNNB1突变型HCC通常表现为“冷肿瘤”(T细胞浸润少),对PD-1/PD-L1抑制剂单药治疗的反应率较低。然而,联合治疗(如与血管生成抑制剂联合)正在探索中。
- WNT通路抑制剂: 针对WNT通路本身的抑制剂仍在早期研发阶段,由于WNT通路在正常组织(如肠道)中的重要作用,开发高选择性、低毒性的抑制剂是巨大的挑战。
基于Nature的研究,将mTOR抑制剂纳入CTNNB1突变型HCC的治疗方案,无论是作为单药还是联合用药,都应成为未来临床研究的重点。
联合治疗的探索方向
研究揭示了mTOR通路在增殖中的核心地位,提示了联合治疗的潜力:
- mTOR抑制剂 + MAPK抑制剂: 由于MAPK信号升高是逃避分化的关键,联合抑制mTOR和MAPK通路,可能从两个维度打击肿瘤细胞的生存和增殖。
- mTOR抑制剂 + 免疫治疗: mTOR抑制剂可能通过调节肿瘤微环境,将“冷肿瘤”转化为“热肿瘤”,从而增强免疫检查点抑制剂的疗效。
- mTOR抑制剂 + 血管生成抑制剂: 经典的HCC治疗方案,mTOR抑制剂与仑伐替尼或索拉非尼等药物的联合,可能通过多通路阻断实现更深层次的肿瘤控制。
面对复杂的癌症治疗方案和药物选择,患者和家属可以通过 MedFind 的 AI 辅助问诊服务,快速解读病理报告和研究文献,获得个性化的治疗建议参考。
基因检测的重要性
对于HCC患者而言,进行全面的基因检测(NGS)以确定包括CTNNB1在内的关键突变状态至关重要。只有明确了肿瘤的分子驱动力,才能将患者精准地分层到最可能受益的治疗方案中。例如,如果检测报告显示CTNNB1突变,并且伴随mTOR通路相关基因的异常,那么mTOR抑制剂的治疗优先级就应被提高。
总结与患者行动指南
这项Nature研究不仅揭示了肝细胞癌发生的复杂性,强调了肝脏微环境(区域化)的重要性,更重要的是,它明确指出了CTNNB1突变型HCC的增殖依赖于IGFBP2-mTOR-Cyclin D1通路。这一发现为我们提供了针对这一难治性亚型的新靶点和治疗思路。
对于CTNNB1突变型HCC患者及其家属:
- 了解分子分型: 积极与医生沟通,进行全面的基因检测,明确CTNNB1突变状态。
- 关注mTOR抑制剂: 询问医生mTOR抑制剂(如依维莫司)是否适合作为您的治疗选择,尤其是在标准治疗效果不佳或耐药后。
- 探索临床试验: 关注针对CTNNB1突变或mTOR通路抑制剂的最新临床试验,这可能是获取前沿治疗的机会。
MedFind 持续关注全球前沿的癌症治疗进展、药物信息和权威指南解读,帮助患者和家属做出更明智的治疗决策。