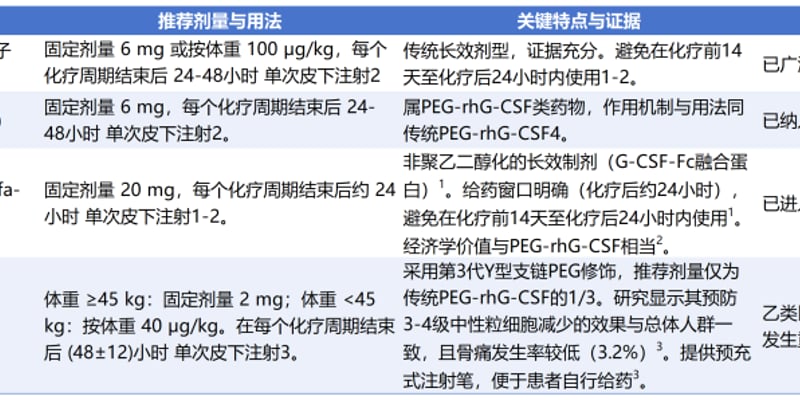
抗坏血酸,即我们熟知的维生素C,作为一种天然抗氧化剂,近年来在肿瘤治疗领域展现出巨大潜力。研究发现,高剂量维生素C不仅能有效抗氧化,还能通过增强肿瘤的获得性免疫反应,帮助免疫系统识别并清除癌细胞。然而,其临床应用面临诸多挑战:体内稳定性差、代谢迅速、肿瘤组织积累有限,以及可能引发肾功能损害等副作用,使得其抗肿瘤效果难以持续且存在安全隐患。
维生素C衍生物突破:超分子凝胶协同PD-1抗体,乳腺癌免疫治疗新策略
面对这些挑战,中国科学院上海药物研究所沈诗洋和黄永焯团队取得了突破性进展。他们在国际权威期刊《ACS Nano》上发表研究,成功开发出一种基于抗坏血酸衍生的超分子凝胶。这种创新凝胶系统通过单次瘤内注射,能够持续释放抗坏血酸,诱导癌细胞发生免疫原性铁死亡,并与免疫检查点阻断疗法(如PD-1抗体)联用,展现出显著的协同抗肿瘤效果。这项研究为乳腺癌等多种癌症的免疫治疗开辟了新方向。

创新凝胶系统:精准靶向与持续释放
该超分子凝胶系统(命名为αPD-1@Lv/HPAGel)的制备过程精妙而高效。它首先通过血红蛋白(Hb)与洛伐他汀(Lv)形成纳米粒,随后与抗坏血酸棕榈酰酯(AP)进行超分子组装,并同步包载PD-1抗体。瘤内注射后,凝胶在酯酶作用下持续释放抗坏血酸和PD-1抗体。血红蛋白提供的氧气促进抗坏血酸氧化为脱氢抗坏血酸(DHA),DHA进入癌细胞后破坏其氧化还原稳态,与洛伐他汀共同下调GPX4的表达,从而高效诱导癌细胞发生铁死亡。
双重机制:激活免疫,精准杀伤
铁死亡过程中释放的免疫原性物质(DAMPs)能够进一步促进树突状细胞的成熟与抗原呈递,有效激活T细胞的免疫反应。与此同时,凝胶释放的PD-1抗体能够解除T细胞的免疫检查点抑制,进一步增强T细胞对癌细胞的杀伤作用。这种“三合一”的协同策略,从多个维度有效抑制肿瘤进展,为癌症患者提供了更具潜力的治疗选择。

超分子凝胶系统的组装过程及免疫治疗机制
卓越的缓释与安全性:临床转化潜力巨大
αPD-1@Lv/HPAGel展现出典型的微观网络结构和良好的粘弹性,确保了其在肿瘤部位的有效局部缓释和较长时间的体内滞留。体内实验证实,该凝胶系统具有良好的生物降解性和安全性,注射后未观察到明显的组织损伤或脏器毒副作用,且完全降解后无残留物。这些特性为该创新疗法的临床转化奠定了坚实基础。

超分子凝胶系统的表征及其降解、体内滞留特性
乳腺癌模型中的显著疗效:抑制转移与预防复发
在小鼠原位乳腺癌合并肺转移模型中,αPD-1@Lv/HPAGel通过诱导铁死亡,显著抑制了原位乳腺癌的生长,并有效减少了肺转移。治疗后,肺部肿瘤结节数显著减少,同时促进了肺部促炎细胞因子的上调及免疫细胞的浸润,增强了抗肿瘤免疫反应。更令人鼓舞的是,流式细胞术结果显示,CD8+ T细胞在转移性肺部肿瘤中的富集,表明原位治疗所引发的免疫应答可对转移癌细胞进行有效杀伤。

超分子凝胶系统在原位乳腺癌肺转移模型中的治疗效果
在小鼠乳腺癌术后切除再挑战模型中,原位肿瘤切除后局部注射αPD-1@Lv/HPAGel,不仅显著抑制了手术部位的肿瘤复发,还有效降低了远端二次荷瘤的小鼠肿瘤发生率,显著减缓了肿瘤的生长速度。免疫分析显示,治疗促进了CD8+ T细胞在肿瘤部位的浸润,并增强了中枢记忆T细胞的生成,表明该凝胶系统不仅能有效控制肿瘤生长,还能诱导持久的免疫记忆,从而有效预防术后肿瘤复发。

超分子凝胶系统在原位乳腺癌术后切除再挑战模型中的治疗效果
展望未来:癌症治疗的新希望
这项研究开发的“三合一”超分子凝胶系统,通过结合大剂量抗坏血酸与PD-1抗体免疫检查点阻断疗法,显著增强了免疫治疗效果。它为抗坏血酸在肿瘤治疗中的应用开辟了新方向,也为肿瘤免疫治疗的联合与增敏提供了创新策略,展现出重要的转化应用潜力。对于寻求最新癌症治疗方案的患者,了解前沿研究至关重要。如果您对海外靶向药或创新疗法感兴趣,MedFind提供专业的海外靶向药代购服务,助您获取所需药品。
在探索个性化治疗方案时,MedFind的AI问诊服务可以为您提供初步的药物信息和诊疗建议。同时,MedFind还提供丰富的抗癌资讯,包括药物信息和诊疗指南,帮助患者和家属更好地了解疾病和治疗选择。