自2011年首个CTLA-4抑制剂获批以来,免疫检查点阻断(ICB)疗法已成为癌症治疗的重要支柱。然而,临床数据显示,仅有20%-40%的癌症患者能从中获益,且超过60%的患者会遭遇结肠炎、肺炎等严重的免疫相关不良事件(irAE)。传统的解决方案往往陷入“增效即增毒”的困境,难以平衡疗效与副作用。
面对这一挑战,肠道微生物群作为人体的“第二基因组”,逐渐被认为是破解难题的关键。多项研究已证实,肠道菌群组成直接影响ICB疗效。近日,浙江大学团队在Cell子刊Cell Biomaterials上发表重磅研究,题为《Enhancing anti-tumor immunity and reducing toxicity: A medicine and food homology formula for ICB therapy》,为癌症免疫治疗开辟了新路径。
药食同源新配方:CV/APS-MS的突破性应用
该研究创新性地开发了一种药食同源配方——CV/APS-MS,通过微球(MS)共载普通小球藻(C. vulgaris)和黄芪多糖(APS)。这一配方旨在精准调控肠道微生态,从而在改善免疫检查点阻断疗法的癌症免疫治疗效果的同时,显著减少免疫相关不良事件(irAE)风险。这无疑为寻求更安全、更有效癌症治疗方案的患者带来了福音。

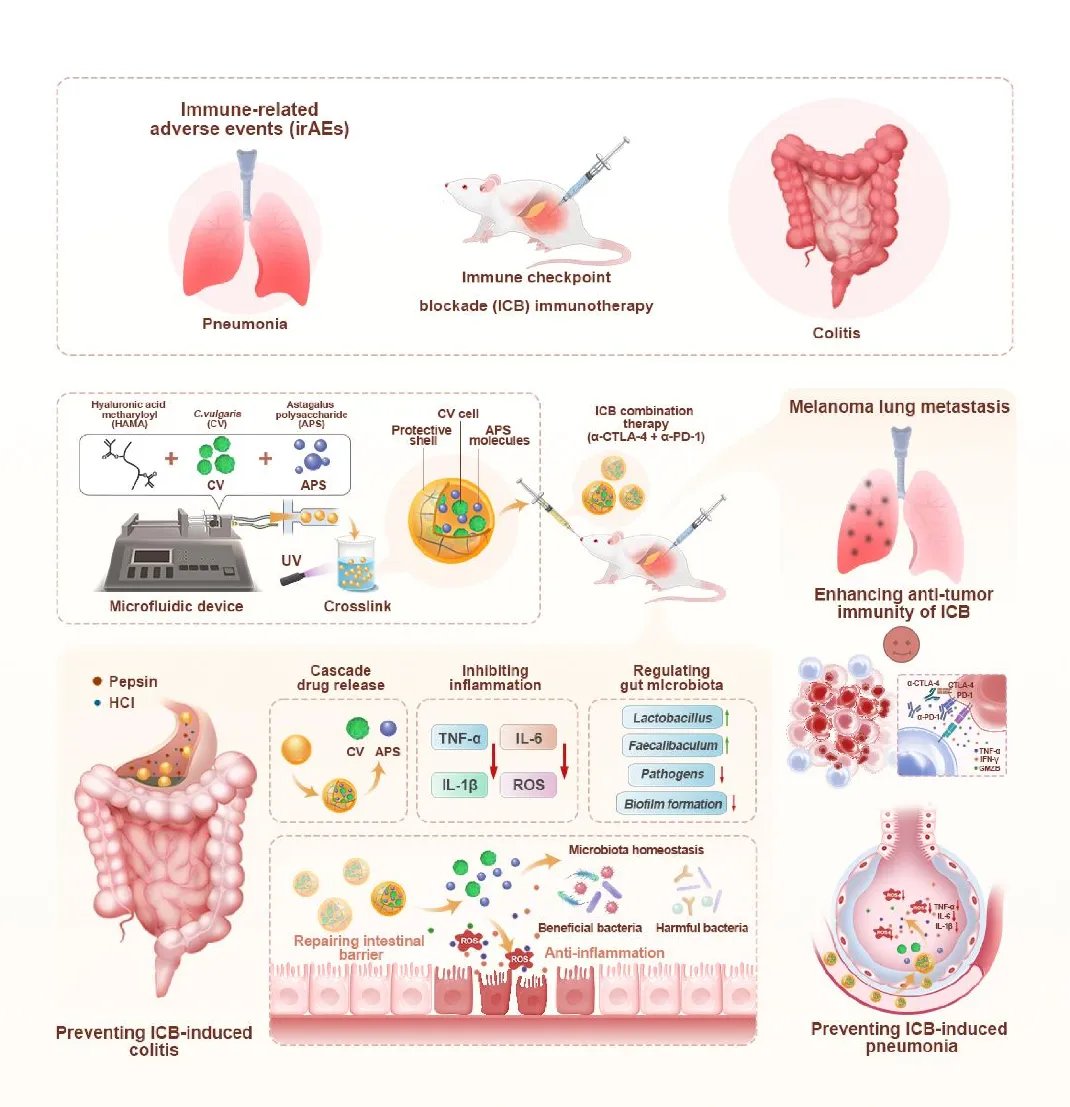
课题示意图:CV/APS-MSs 联合免疫检查点抑制剂提升抗肿瘤疗效并降低免疫相关不良反应的机制
微球里的抗癌智慧
- 天然成分的巧妙组合
研究团队将富含叶绿素、ω-3脂肪酸等活性成分的普通小球藻,与传统中药黄芪的核心成分黄芪多糖封装于微球载体中。小球藻已被证实能增强树突状细胞功能;黄芪多糖则具有调节T细胞亚群平衡、抑制炎症因子释放的双重作用。这种“藻类+多糖”的组合,通过微球技术延长了在肠道的滞留时间,确保了生物活性的持久释放。
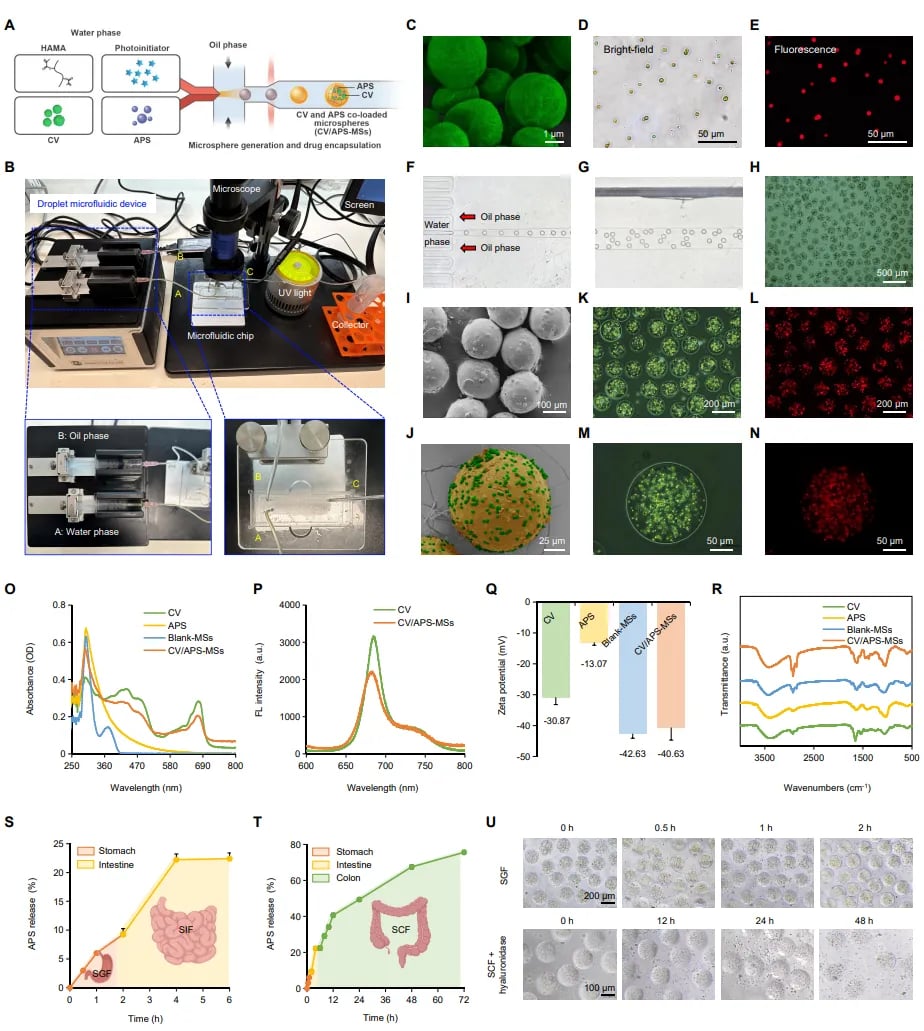
CV/APS-MSs 的制备与表征
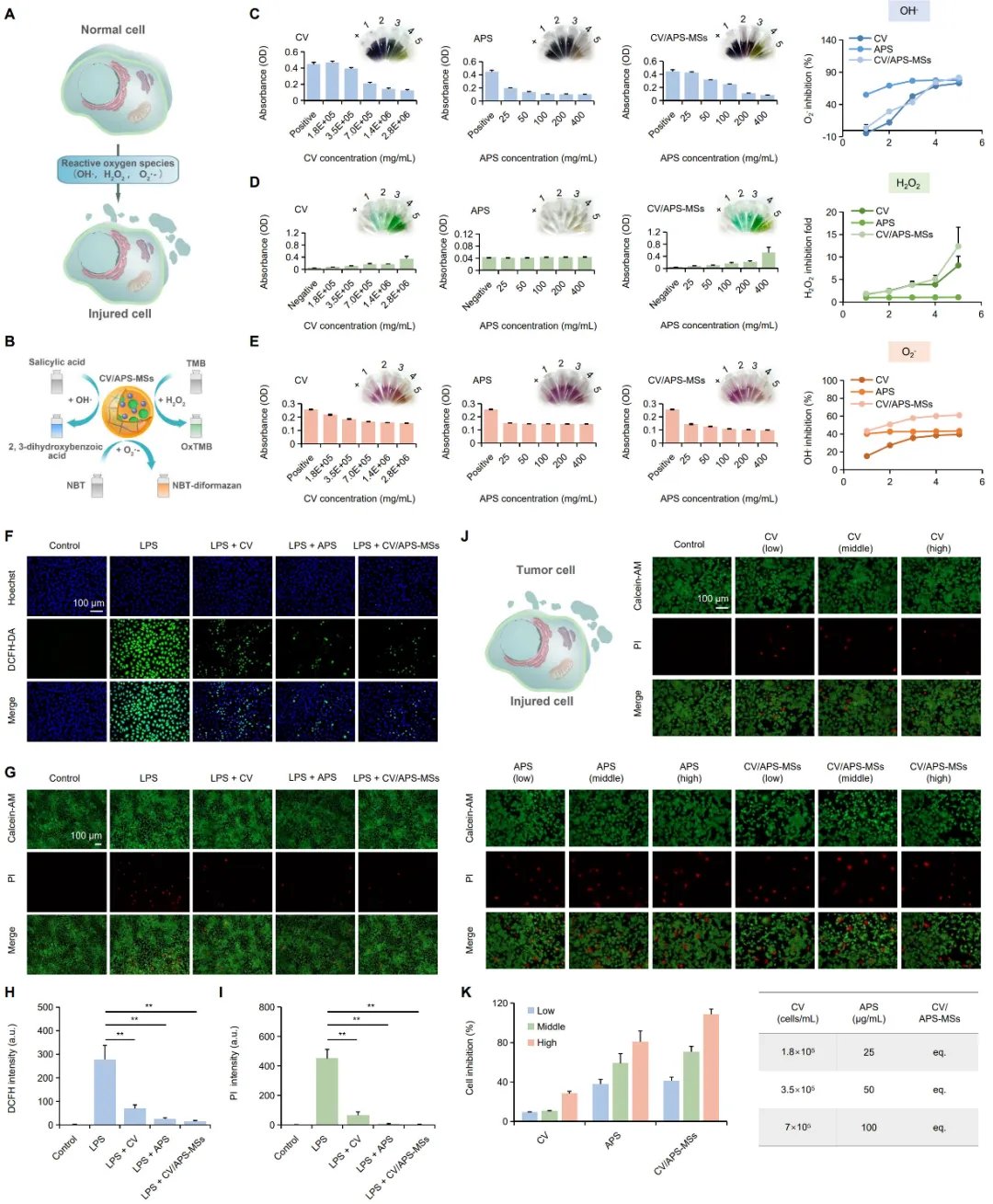
CV/APS-MSs 的抗氧化与抗肿瘤作用
- 动物实验的惊艳数据
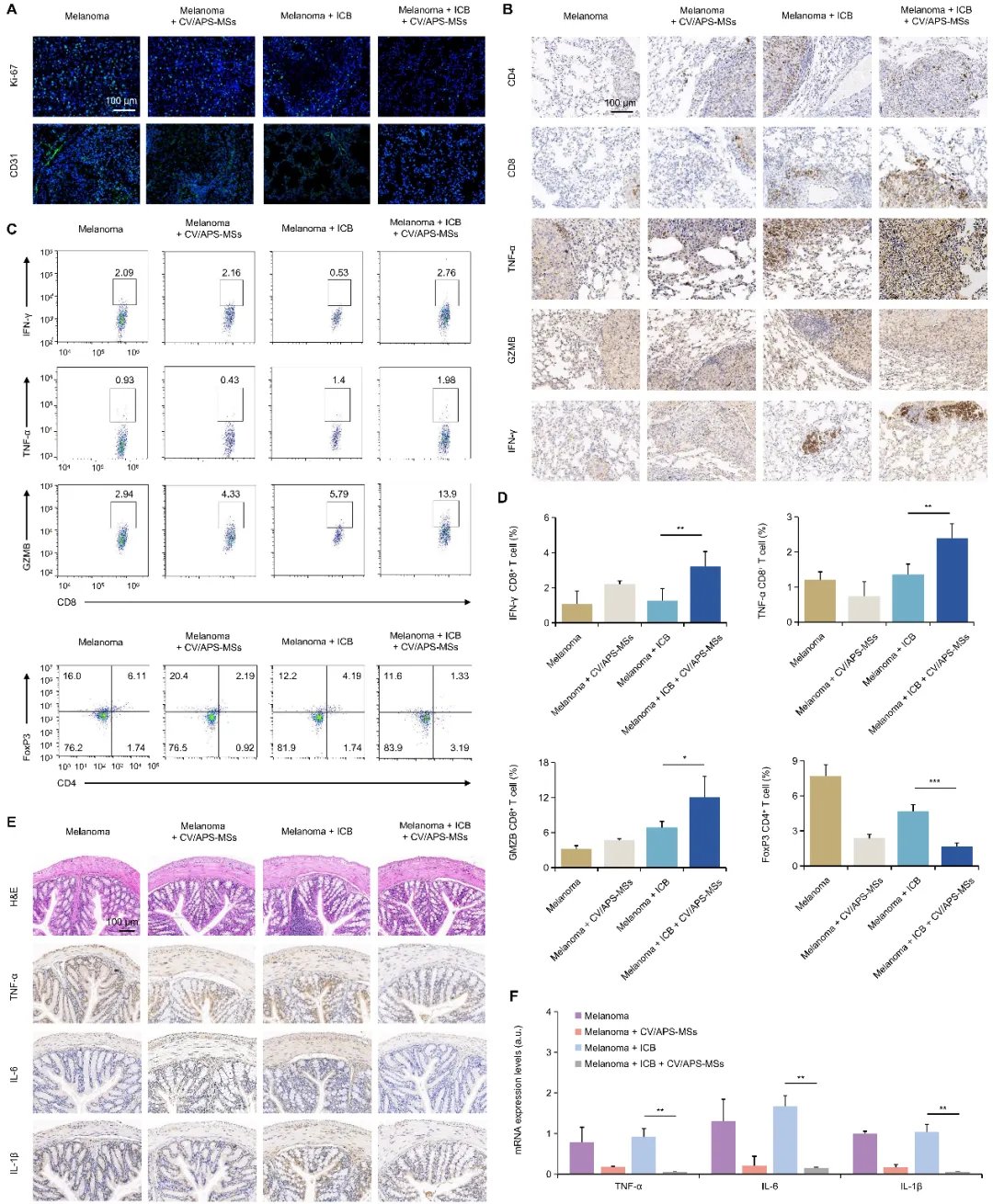
在黑色素瘤肺转移小鼠模型中,CV/APS-MS展现出三重优势:- 增效:治疗组肿瘤体积较对照组缩小58%,CD8+T细胞浸润增加2.3倍,显著激活了系统性抗肿瘤免疫应答。
- 减毒:结肠炎发生率从62%降至18%,肺炎病理评分降低74%,肠道屏障功能指标(如紧密连接蛋白ZO-1)显著改善,大幅降低了免疫治疗副作用。
- 持久:通过16S rRNA测序发现,双歧杆菌、阿克曼氏菌等有益菌丰度提升3-5倍,且菌群结构在治疗结束后4周仍保持稳定。
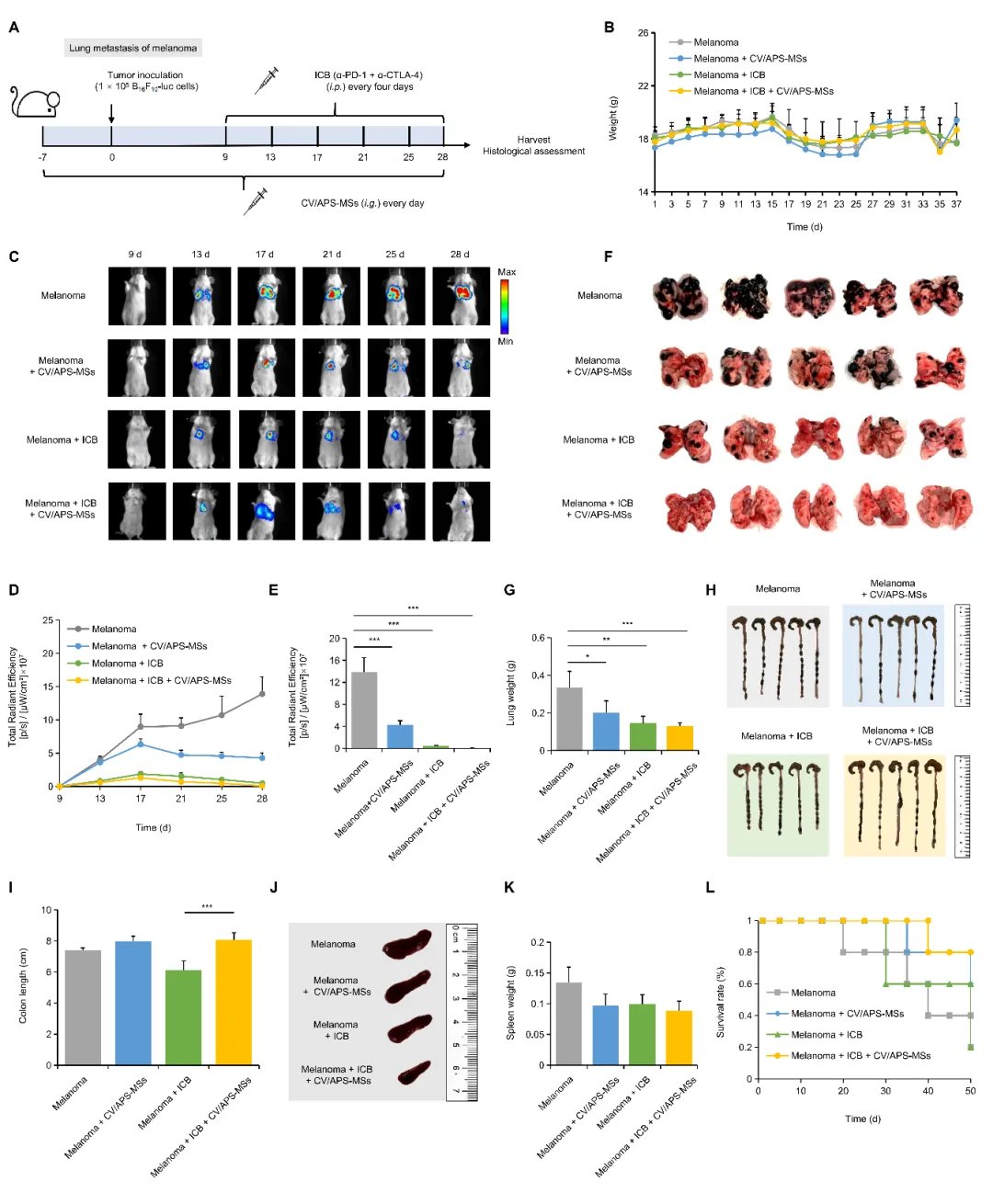
提高黑色素瘤肺转移模型中 ICB 疗效
- 作用机制的深度阐释
研究揭示了CV/APS-MS通过“肠道-免疫”轴调控网络发挥作用:- 菌群代谢重塑:黄芪多糖促进色氨酸代谢生成吲哚-3-丙酸,增强芳香烃受体(AhR)信号通路;小球藻提供亚油酸,经肠道菌群转化为共轭亚油酸(CLA),抑制MDSC细胞扩增。
- 免疫微环境优化:通过调节Th17/Treg比例,降低IL-6、TNF-α等促炎因子,同时提升IL-10、TGF-β等抗炎因子水平。
- 屏障功能强化:微球释放的活性成分可促进黏液层分泌,增加杯状细胞数量,形成“生物防护层”减少毒素入血。
缓解 irAEs 并增强抗肿瘤免疫反应
临床转化:从实验室到病床的跨越
这项临床研究为肿瘤治疗提供了三大启示:
- 个体化治疗新维度:通过肠道菌群检测(如16S测序、宏基因组学),可筛选出最可能从CV/APS-MS获益的患者群体。
- 联合用药新策略:与PD-1抑制剂联用时,建议采用“先食疗后免疫”的序贯方案,以最大化菌群调控效果。
- 毒副作用预警体系:监测粪便短链脂肪酸(SCFA)水平,可早期预测irAE发生风险。
目前,研究团队已启动I期临床试验(NCT05678912),招募30例晚期实体瘤患者。初步数据显示,联合CV/APS-MS治疗组3级以上irAE发生率较单药组降低41%,且客观缓解率(ORR)提升17%。这些积极结果预示着该疗法在未来癌症治疗中的巨大潜力。
对于正在寻找最新抗癌资讯和新疗法的癌症患者,了解此类临床研究进展至关重要。您可以通过MedFind获取更多药物信息、诊疗指南等抗癌资讯,或尝试AI问诊服务,获取个性化建议。
总结:传统智慧的现代重生
当黄芪遇见微藻,当食疗邂逅免疫治疗,这场跨越千年的医学对话,为肿瘤治疗开辟了新纪元。CV/APS-MS微球不仅是一种新型辅助治疗手段,更代表了一种“整体观”医疗理念——通过调节人体微生态系统,实现“增效-减毒-提质”的三重目标。对于需要海外靶向药代购服务的患者,MedFind致力于提供便捷可靠的渠道,助力患者获取全球前沿药物。





