引言:当“生物导弹”遭遇耐药挑战
抗体偶联药物(ADC)作为一种创新的“生物导弹”,通过精准靶向癌细胞并递送强效化疗药物,彻底改变了许多癌症(尤其是乳腺癌)的治疗格局。然而,一个严峻的现实是,许多晚期癌症患者在使用ADC药物一段时间后,会不可避免地出现耐药问题,导致治疗效果下降。为什么这些先进的药物会失效?了解其背后的耐药机制,对于寻找新的治疗方案、选择后续药物至关重要。本文将为您深入剖析ADC药物产生耐药的三大核心原因。
一、抗原靶点变化:肿瘤细胞的“隐身术”
ADC药物的精准性依赖于识别并结合肿瘤细胞表面的特定抗原(即“靶点”)。如果肿瘤细胞减少或改变了这些靶点的表达,ADC药物就如同失去了导航的导弹,无法准确命中目标。
1. HER2表达水平下降与异质性
以治疗HER2阳性乳腺癌的知名ADC药物恩美曲妥珠单抗(T-DM1,商品名:赫赛莱)为例,其疗效与肿瘤细胞表面的HER2蛋白数量密切相关。研究发现,HER2表达水平更高、更均匀的肿瘤,对T-DM1的反应更好。然而,在治疗过程中,部分肿瘤细胞的HER2表达会降低,或者肿瘤内部不同细胞的HER2表达水平出现巨大差异(即异质性)。这种靶点丢失或表达不均,是导致T-DM1耐药的关键因素之一。临床研究证实,治疗前就存在HER2异质性的患者,治疗效果往往不佳。
2. 靶点被“屏蔽”
除了靶点数量减少,抗原靶点与其他分子结合也可能导致ADC药物失效。例如,当HER2与HER3蛋白形成“二聚体”时,会干扰T-DM1的抗癌活性。幸运的是,这种耐药有时可以通过联合用药来克服,例如联合使用能够阻断HER2/HER3二聚化的帕妥珠单抗(Perjeta),可以恢复T-DM1的疗效。
二、药物内化与处理障碍:ADC的“坎坷入城路”
即便ADC药物成功结合了靶点,它还需要被肿瘤细胞“吞噬”并运送到指定位置释放“弹头”(细胞毒性药物),才能发挥杀伤作用。这个过程中的任何一个环节出现问题,都可能导致耐药。
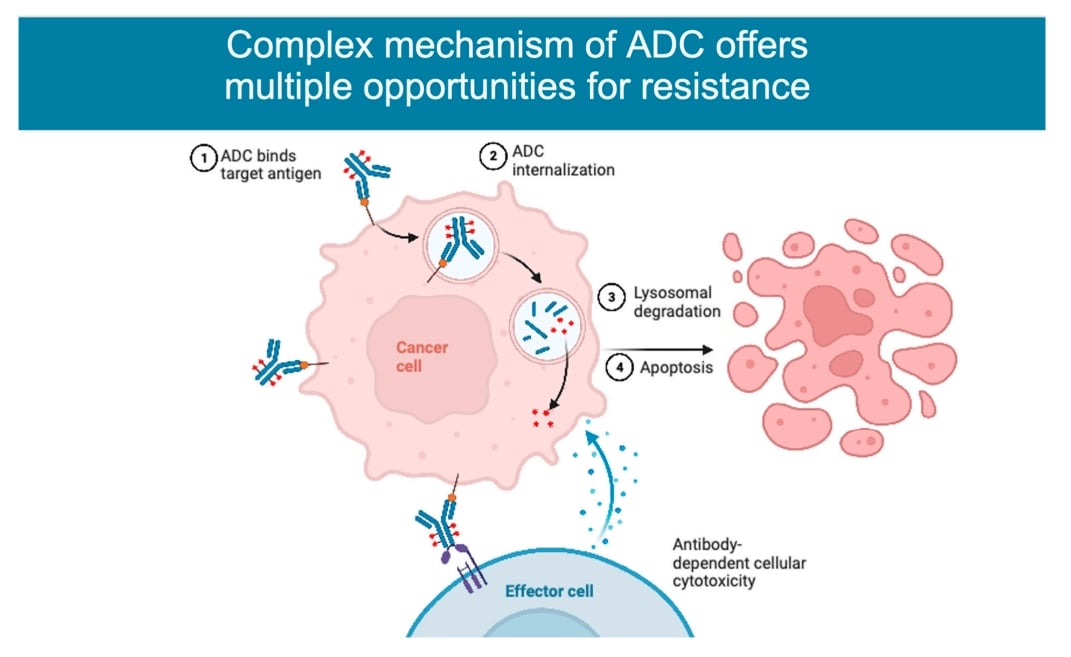
1. 药物摄取效率降低
肿瘤细胞可能通过改变其内吞方式来阻碍ADC的进入。正常情况下,ADC通过高效的“网格蛋白介导的内吞”进入细胞。但耐药的肿瘤细胞可能会转向效率较低的“小窝蛋白介导的内吞”途径,从而减少了进入细胞内部的药物总量。
2. 内部运输与释放受阻
进入细胞后,ADC需要被运输到溶酶体中,在那里连接子被切断,释放出具有杀伤力的化疗“弹头”。研究发现,在对T-DM1耐药的细胞中,溶酶体的加工处理过程可能出现异常,导致“弹头”无法被有效释放,药物最终失效。
三、细胞毒性“弹头”失效:当武器失灵
ADC的最终杀伤力来自其携带的细胞毒性“弹头”。如果肿瘤细胞对这种“弹头”本身产生了抵抗力,那么即使药物成功进入细胞,也无法有效杀死它们。
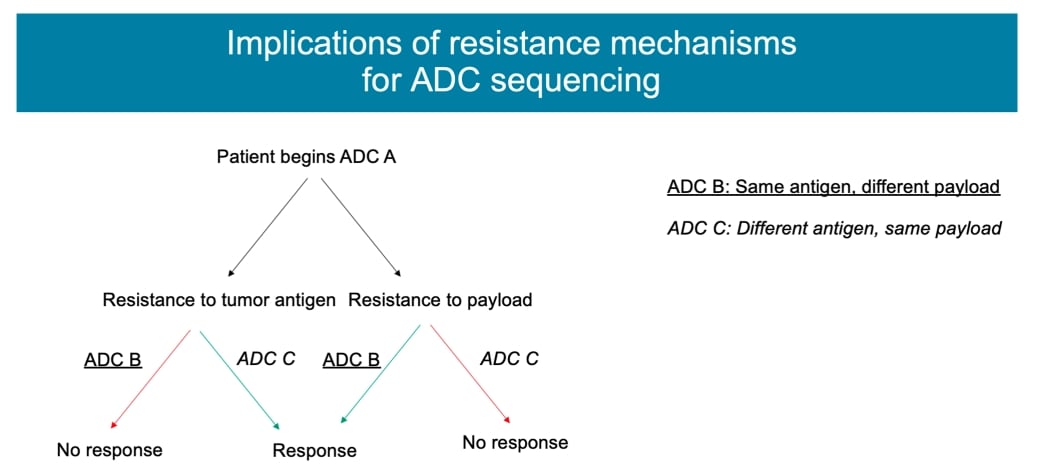
1. 对“弹头”产生耐受
这与传统化疗耐药的机制类似。例如,某些ADC药物的“弹头”是拓扑异构酶抑制剂,如果肿瘤细胞中该酶的表达或功能发生改变,就可能导致耐药。一个重要的临床启示是,当对一种ADC药物耐药后,更换另一种携带不同“弹头”的ADC药物可能依然有效。例如,许多对T-DM1耐药的乳腺癌患者,在使用新一代ADC药物德曲妥珠单抗(DS-8201a/T-DXd,商品名:优赫得)后,仍然可以获得良好的治疗效果,这正是因为后者的“弹头”和作用机制不同。
2. 药物被主动“泵”出细胞
肿瘤细胞还会进化出一种“外排泵”(如ATP结合盒转运蛋白),它能像水泵一样,将进入细胞内的化疗药物主动泵出,使其无法达到有效杀伤浓度。研究显示,在对吉妥珠单抗奥唑米星(Gemtuzumab Ozogamicin)等ADC药物耐药的案例中,都观察到了这种外排泵蛋白的过度表达。
总结与展望:如何应对ADC耐药?
ADC药物的耐药是一个复杂的过程,涉及靶点、药物转运和“弹头”效应等多个层面。理解这些机制为我们克服耐药提供了清晰的方向。未来的策略可能包括:
- 开发新型ADC药物:例如,设计能靶向多个抗原的“双靶点ADC”,或使用对耐药细胞依然有效的新型“弹头”。
- 优化联合治疗方案:将ADC与其他靶向药、免疫疗法或化疗联合使用,协同增效,延缓耐药的发生。
- 合理的序贯治疗:在一种ADC药物耐药后,科学地选择另一种不同机制的ADC药物(如T-DM1耐药后使用T-DXd),是延长患者生存期的关键策略。
随着研究的深入,更多克服ADC耐药的新药和新方案将不断涌现。对于面临耐药挑战的患者而言,及时获取这些前沿药物(如德曲妥珠单抗)的详细信息,包括其最新临床数据、副作用、全球价格及可靠的购买渠道,是与医生共同制定下一步最佳治疗方案的重要基础。