引言:当肺腺癌“变身”
对于携带EGFR突变的肺腺癌患者而言,EGFR靶向药(TKI)的出现极大地改善了治疗效果。然而,耐药几乎是不可避免的终点。在众多耐药机制中,一种相对罕见但棘手的情况是——肿瘤组织学类型发生了转化,例如从肺腺癌“变身”为小细胞肺癌或鳞状细胞癌。其中,向鳞状细胞癌的转化机制尚不完全明了。本文将通过一个详细的病例,探讨EGFR突变肺腺癌向鳞癌转化的潜在遗传驱动因素,特别是新发现的FGFR1和NSD3基因扩增所扮演的角色。
病例回顾:一位患者的漫长抗癌之路
该病例的主角是一位66岁的男性患者,有8包年的吸烟史。他的抗癌历程跨越了数年,期间经历了多次治疗方案的更迭和肿瘤的演变:
- 2018年6月: 患者因咳嗽就诊,最终确诊为IVa期肺腺癌,基因检测发现经典的 EGFR L858R 突变。随即开始一线治疗,使用靶向药阿法替尼,并取得了部分缓解。
- 2021年6月: 肿瘤增大,出现疾病进展。第二次活检证实仍为肺腺癌,但基因检测发现了新的耐药突变 T790M。因此,治疗方案更换为三代EGFR靶向药奥希替尼。
- 2022年3月: 约10个月后,肿瘤再次增大。第三次活检显示仍为腺癌,但T790M突变消失。患者转为三线化疗(卡铂+培美曲塞+贝伐珠单抗)。
- 2022年11月: 疾病再次进展,更换为四线治疗(多西他赛+雷莫芦单抗)。
- 2023年3月: 肿瘤迅速增大,医生怀疑组织学发生转化。第四次活检最终证实,肿瘤已转化为鳞状细胞癌。
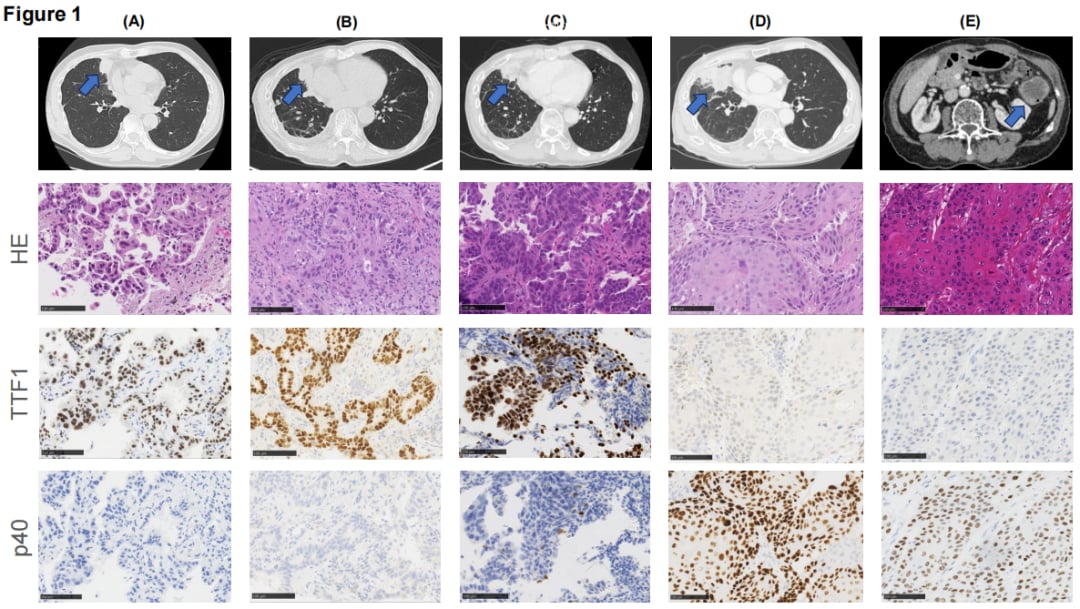
▲图1:肿瘤组织学形态随时间的变化
基因检测揭秘:驱动转化的“幕后黑手”
在确诊为鳞状细胞癌后,对活检组织的下一代测序(NGS)分析带来了突破性发现。结果显示,在转化为鳞癌的组织中,新出现了 FGFR1 和 NSD3 基因的扩增,而这些变异在之前的检测中并未发现。值得注意的是,自始至终,EGFR L858R突变一直存在,这表明肿瘤是“转化”而来,而非新发的原发性鳞癌。
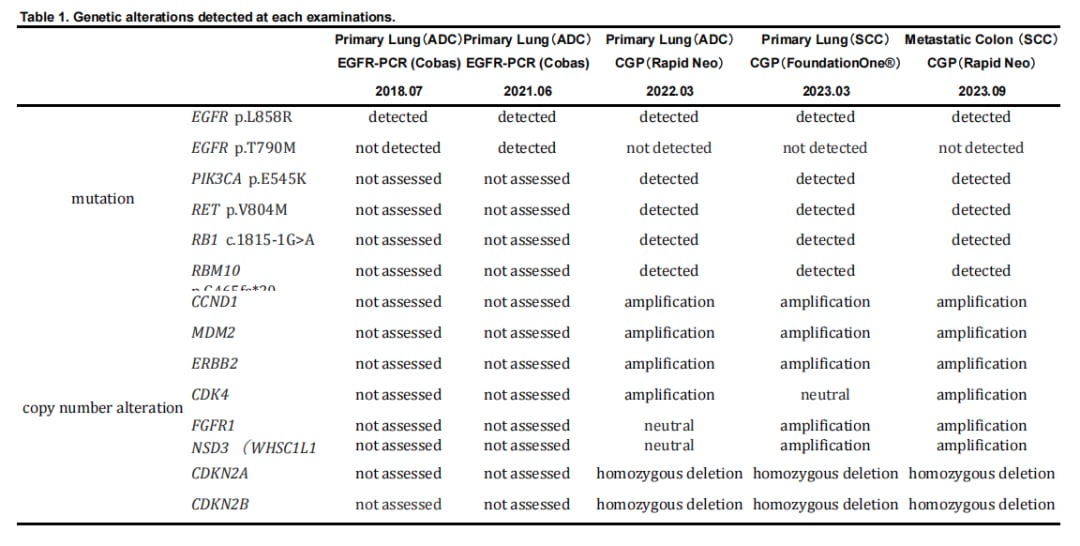
▲表1:历次基因检测结果汇总
尽管患者后续接受了放疗、化疗以及阿法替尼再挑战等多种治疗,但病情未能得到有效控制,最终不幸离世。尸检结果也证实,原发灶主要由鳞状细胞癌构成,而转移灶则同时存在鳞癌和腺癌两种成分。这一系列发现强烈暗示,FGFR1和NSD3的扩增可能是在长期治疗压力下,驱动肺腺癌向鳞状细胞癌转化的关键分子事件。
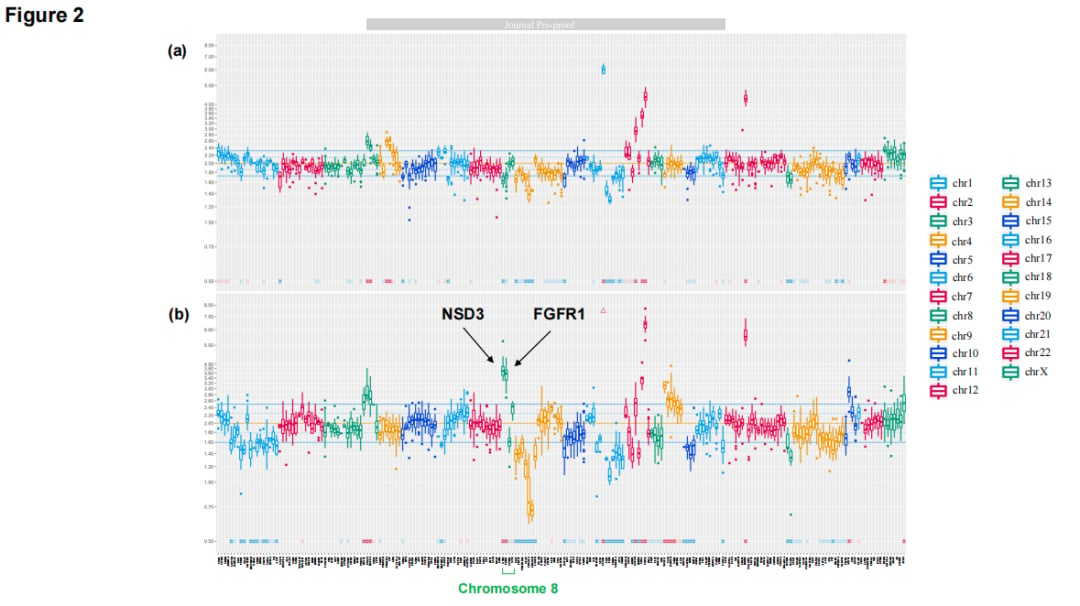
▲图2:基因组拷贝数变异分析图
临床启示与未来方向
这个病例为临床实践提供了宝贵的启示:
- 再活检的重要性: 当靶向治疗后出现耐药或疾病进展时,不能理所当然地认为肿瘤性质未变。进行再次活检和病理分析至关重要,因为组织学转化会彻底改变后续的治疗策略。
- 动态基因监测的价值: 肿瘤是不断进化的。通过NGS等全面的基因检测手段,动态监测肿瘤的基因组变化,有助于我们理解耐药机制,并发现新的治疗靶点,如本例中的FGFR1。
- 未来治疗的可能: FGFR1扩增本身就是一个潜在的治疗靶点。对于出现此类变异的患者,未来可能需要寻找针对FGFR靶点的新药。届时,这些新药的价格、哪里购买以及可靠的代购渠道,将成为患者和家属关注的焦点。
总之,该病例首次将FGFR1和NSD3扩增与EGFR突变肺腺癌向鳞癌的转化联系起来,强调了在癌症的长期管理中,通过重复活检和基因测序来洞察肿瘤演变机制的必要性,这为实现更精准的个体化治疗铺平了道路。
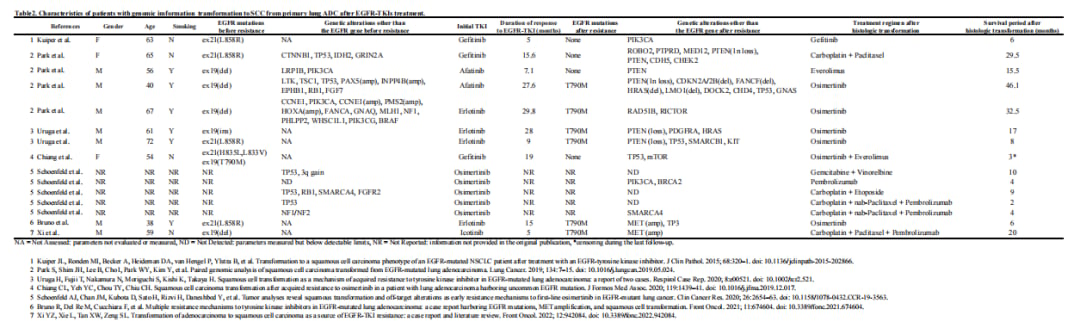
▲表2:EGFR-TKI治疗后肺腺癌转化为鳞癌患者的基因特征文献回顾