引言
对于许多晚期食管鳞状细胞癌(ESCC)患者而言,在接受免疫检查点抑制剂(ICI)治疗后若出现疾病进展,后续的治疗选择十分有限,疗效也不尽人意。然而,一项发表于国际顶级医学期刊《Nature Medicine》的研究为这些患者带来了新的希望。研究结果显示,一款名为BL-B01D1的创新抗体药物偶联物(ADC)在治疗转移性食管鳞癌中表现出令人鼓舞的疗效和可控的安全性。
BL-B01D1:靶向EGFR和HER3的新型ADC药物
BL-B01D1是一款潜在的“首创”(first-in-class)ADC药物。它的独特之处在于其“双靶点”设计:
- 双特异性抗体:能够同时识别并结合肿瘤细胞表面的两种蛋白——表皮生长因子受体(EGFR)和人表皮生长因子受体3(HER3)。在50%-70%的食管鳞癌中都存在EGFR过表达,而同时靶向EGFR和HER3被认为可以更全面地阻断肿瘤信号,并可能克服对单一靶向EGFR疗法的耐药性。
- 高效载荷:通过一个可裂解的连接子,抗体携带了名为Ed-04的拓扑异构酶I抑制剂。当BL-B01D1与癌细胞结合后,会被细胞吞噬,随后释放出化疗载荷,精准地破坏癌细胞的DNA,导致其死亡。
这种设计就如同一个“生物导弹”,能够精准定位并摧毁癌细胞,同时尽量减少对正常组织的伤害。

临床研究揭示:BL-B01D1的显著疗效
这项1b期临床试验(NCT05262491)共纳入了82名既往接受过治疗的转移性食管鳞癌患者。研究结果显示,BL-B01D1的疗效非常突出,尤其是在推荐的II期剂量(RP2D)组中:
- 在接受2.5 mg/kg剂量治疗的53名可评估患者中,确认的客观缓解率(cORR)高达39.6%。
- 该剂量组的疾病控制率(DCR)达到了79.2%,意味着近八成患者的肿瘤得到有效控制(缩小或稳定)。
- 相比之下,2.0 mg/kg剂量组的cORR为15.0%,DCR为50.0%。
基于这些优异数据,研究确定了2.5 mg/kg(每三周的第1天和第8天给药)作为后续III期临床试验的推荐剂量。对于已经对标准化疗和免疫治疗产生耐药性的患者群体来说,接近40%的客观缓解率是一个重大的突破。
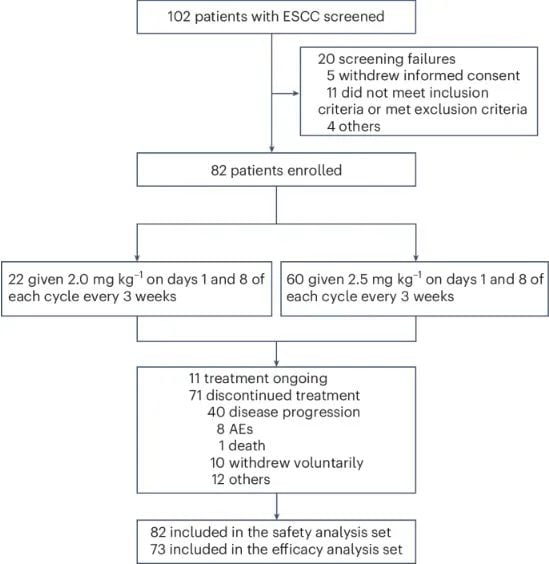
图1 CONSORT图(图源自Nature Medicine)
BL-B01D1的安全性与副作用分析
在评估新药时,安全性与疗效同等重要。研究表明,BL-B01D1的副作用是可预见且临床可控的。在2.5 mg/kg剂量组中,最常见的3级及以上治疗相关不良事件主要为血液学毒性,包括:
- 贫血(28.3%)
- 白细胞减少(18.3%)
- 血小板减少(18.3%)
- 中性粒细胞减少(16.7%)
值得注意的是,研究中观察到两例3级以上的间质性肺病(ILD),这是一种需要密切监测的潜在严重副作用。总体而言,在经验丰富的医疗团队的监护下,BL-B01D1的安全性风险是可管理的。
总结与展望
BL-B01D1的1b期临床研究为经治的晚期食管鳞癌患者带来了新的治疗方向。它凭借创新的双靶点设计,在难治性患者中展现了卓越的抗肿瘤活性和可接受的安全性。目前,更大规模的III期临床试验已经启动,旨在进一步验证其疗效和安全性。
随着研究的深入,未来BL-B01D1的价格和购买渠道将是患者关注的焦点。MedFind将持续跟进该药物的最新进展,为有需要的患者提供及时的代购资讯和支持,帮助患者第一时间获取全球前沿的治疗选择。