FGFR1突变与PPGL:一种罕见的驱动基因
嗜铬细胞瘤(PCCs)和副神经节瘤(PGLs),合称为PPGL,是一类罕见的神经内分泌肿瘤。高达40%的PPGL具有遗传性,而其余散发性病例中也有相当一部分携带体细胞驱动突变。因此,基因检测在PPGL的诊断和治疗中扮演着至关重要的角色。近年来,成纤维细胞生长因子受体1(FGFR1)的致病性突变被发现与PPGL相关,但其具体的临床特征和最佳治疗策略尚不完全明确。了解这些罕见突变对于制定个体化治疗方案至关重要。如果您对自己的基因检测报告或治疗方案有疑问,可以咨询MedFind的AI问诊服务,获取专业的解读和建议。
本文将通过分析4例携带FGFR1体细胞突变的PPGL患者,深入探讨其临床表现、生化指标、影像学特征以及潜在的治疗方案,为临床医生和患者提供有价值的参考。
四例FGFR1突变PPGL患者病例深度分析
这四例患者的临床情况展现了FGFR1突变PPGL的多样性。

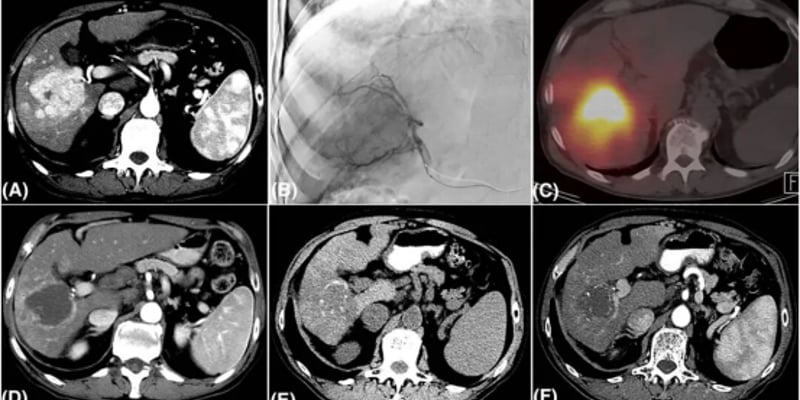
病例1:一名67岁女性,因发作性高血压和心悸就诊,最终发现左侧肾上腺存在一个4.2×3.9 cm的嗜铬细胞瘤。生化检查显示甲氧基肾上腺素(MN)和甲氧基去甲肾上腺素(NMN)水平均显著升高。手术切除后,肿瘤组织基因检测发现了致病性FGFR1突变。
病例2:一名72岁男性,有复发性右侧嗜铬细胞瘤病史。首次发病于61岁,手术切除后8年复发。影像学检查发现右肾上腺窝复发病灶,并伴有肝脏可疑病灶。再次手术切除后,肿瘤基因检测同样显示存在FGFR1突变。
病例3:一名15岁男性,因转移性副神经节瘤就诊。患者12岁时因腹部巨大肿块确诊,术后影像学检查发现已存在广泛的骨、肝、肺转移。肿瘤基因检测显示FGFR1突变。患者接受了两次131I-MIBG放射性核素治疗,病情得到稳定控制。
病例4:一名63岁男性,因转移性复发性副神经节瘤就诊。初诊为腹膜后巨大副神经节瘤,术后8个月即出现局部复发和骨转移。病情进展迅速,分子病理学显示除了FGFR1突变外,还伴有TP53缺失等其他基因变异。

FGFR1突变PPGL的诊疗要点总结
综合分析这四例患者,我们可以总结出FGFR1突变PPGL的一些关键特征:
- 临床表现多样: 疾病谱范围广泛,既可表现为局限性的良性肾上腺肿瘤,也可能在初诊时就已是广泛转移的侵袭性疾病。典型的高血压、心悸等症状并非所有患者都会出现。
- 生化表型不一: 部分患者表现为典型的肾上腺素能或去甲肾上腺素能表型(MN和/或NMN升高),但也有患者的生化指标可能正常。值得注意的是,四例患者的嗜铬粒蛋白A水平均有升高,可作为疾病监测的辅助标志物。
- 影像学特征: 在功能影像学检查中,18F-FDOPA PET/CT在检测原发灶和转移灶方面显示出优于或等同于68Ga-DOTATATE PET/CT的敏感性,可能是此类患者首选的功能影像学检查方法。
靶向新希望:FGFR抑制剂在PPGL中的潜力
对于发生转移的PPGL,目前的标准治疗包括化疗、放射性核素治疗和一些酪氨酸激酶抑制剂(TKI)。然而,针对FGFR1这一特定驱动基因的治疗方案尚未成熟。FGFR信号通路的异常激活在多种癌症中都扮演着关键角色,因此,开发针对性的FGFR抑制剂已成为肿瘤治疗的一大热点。
目前,美国FDA已批准三种FGFR抑制剂用于临床,包括厄达替尼(Erdafitinib)、佩米替尼(Pemigatinib)和福巴替尼(Futibatinib)。它们主要获批用于治疗携带FGFR2/3异常的尿路上皮癌和携带FGFR2异常的胆管癌等。尽管这些药物尚未在PPGL中进行专门研究,但其作用机制为FGFR1突变的PPGL患者提供了潜在的治疗可能。

需要注意的是,FGFR抑制剂也存在一些常见的不良反应,如高磷血症、口腔炎、皮肤和眼部毒性等。因此,在考虑使用前,必须由专业医生全面评估其潜在获益与风险。
总结与展望
FGFR1突变是PPGL中一个独特且临床表现多样的亚型。精准的基因检测是识别这类患者并指导个体化治疗的第一步。虽然目前尚无针对FGFR1突变PPGL的特效靶向药获批,但厄达替尼等FGFR抑制剂在其他癌种中的成功应用,为这一罕见肿瘤的治疗带来了新的曙光。未来,需要更多临床研究来验证这些药物在PPGL患者中的疗效和安全性。对于需要这些前沿靶向药物的患者,了解可靠的海外购药渠道和最新的抗癌资讯至关重要。