引言
转铁蛋白受体1(TfR1),又称CD71,是细胞膜上一种广为人知的蛋白质,其主要职责是帮助细胞吸收铁元素——这是细胞生长和活动不可或缺的物质。然而,一项发表于《信号转导与靶向治疗》的重磅研究揭示了TfR1的“隐藏身份”:它在肿瘤进展中扮演着一个远比我们想象中更复杂的角色,尤其是在结直肠癌中。
TfR1的“双重身份”:从铁摄取到肿瘤“帮凶”
传统观点认为,转铁蛋白受体1(TfR1)是细胞的“铁质搬运工”。由于癌细胞生长迅速,需要大量铁元素,因此TfR1在多种肿瘤组织中(尤其是结直肠癌)的表达水平会显著升高。这使得TfR1长期以来被视为一个潜在的肿瘤诊断和治疗靶点。但科学家们一直好奇,TfR1的作用是否仅限于此?新的研究给出了颠覆性的答案。

深入细胞核:TfR1如何与p53“共谋”?
这项由中国科学院大学、南开大学等机构合作的研究发现,TfR1并不仅仅停留在细胞膜上。在特定条件下,它会发生“核易位”——即从细胞膜转移到细胞的指挥中心“细胞核”内。更关键的是,进入细胞核后的TfR1会与一个大名鼎鼎的蛋白相遇并相互作用,它就是p53蛋白。
p53蛋白是人体内最重要的抑癌基因之一,它像一个“基因卫士”,负责修复受损的DNA或引导异常细胞凋亡,从而阻止癌症的发生。然而,研究证实,核内的TfR1与p53的结合,竟会干扰p53的正常功能。
破坏DNA修复:TfR1促进肿瘤进展的关键机制
研究团队通过蛋白质组学、基因组学和转录组学等多重分析发现,TfR1与p53的相互作用,会显著影响p53对其下游靶基因的调控能力,而这些基因大多与DNA损伤修复功能密切相关,特别是“核苷酸切除修复(NER)”通路。
简单来说,核内TfR1的存在,正向调节了NER通路,这反而帮助肿瘤细胞更好地抵抗和修复由化疗等方式引起的DNA损伤。这使得癌细胞更加“顽强”,难以被杀死,从而加速了肿瘤的恶性进展、侵袭和转移。
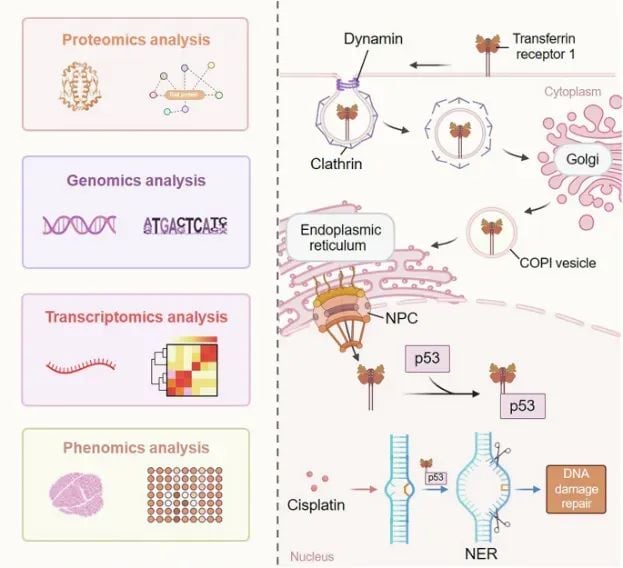
图1 示意图展示了核转运路径以及核内转铁蛋白受体 1 的功能作用(图源自Signal Transduction and Targeted Therapy)
临床意义与未来展望:TfR1能否成为新靶点?
为了验证这一机制的临床相关性,研究人员分析了结直肠癌患者的肿瘤样本。结果证实,肿瘤细胞核内TfR1的水平与肿瘤的恶性程度、侵袭性和转移能力呈显著正相关。这意味着,核内TfR1有望成为一个评估结直肠癌预后的新生物标志物。
更重要的是,这一发现为开发针对TfR1非经典功能的新型靶向药物提供了坚实的理论基础。对于结直肠癌患者而言,这意味着未来可能出现全新的治疗选择。因此,密切关注像TfR1这样的新靶点研究进展,了解相关新药的研发动态、治疗价格和海外代购渠道,对于探索更多治疗可能性、制定最佳治疗方案具有重要意义。