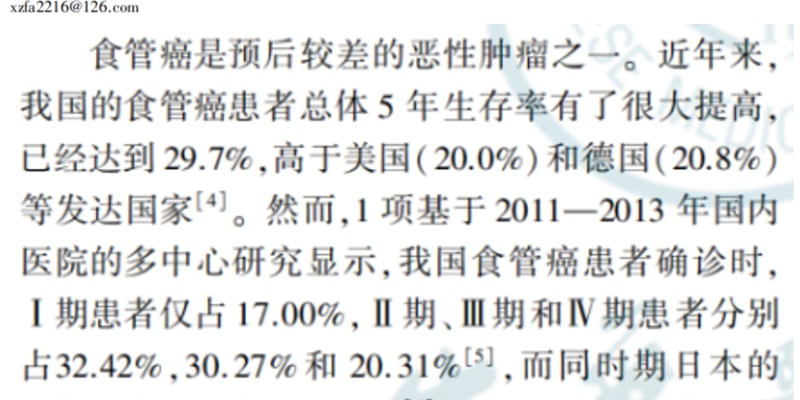
胰腺导管腺癌(PDAC)是预后最差的恶性肿瘤之一,其五年生存率极低,很大程度上归因于现有治疗手段的局限性。PDAC肿瘤微环境复杂,富含间质成分,导致血管生成不足和营养物质供应受限,使得癌细胞高度依赖于特定的代谢途径生存和增殖,例如自噬和溶酶体过程。尽管靶向这些代谢途径在实验室研究中显示出潜力,但找到合适的药物靶点一直是挑战。
PIKfyve:胰腺癌治疗的新潜在靶点
近期发表在国际顶级期刊《Nature》上的一项突破性研究,由密歇根大学Arul M. Chinnaiyan教授团队领导,发现了一种名为PIKfyve的脂质激酶,它在溶酶体功能中扮演关键角色,并被确定为PDAC的一个可靶向的脆弱点。研究人员在基因工程小鼠模型中证实,PIKfyve对于PDAC的发生和进展至关重要。在小鼠和人类胰腺癌样本中,PIKfyve的表达水平显著高于正常组织,且其表达升高与细胞密度增加、营养缺乏等肿瘤微环境特征相关。敲除PIKfyve基因显著抑制了小鼠体内肿瘤的生长和进展,延长了生存期。

【文章要点】
一、PIKfyve对胰腺癌前病变发展至关重要
研究发现,PIKfyve对于胰腺上皮内瘤样病变(PanIN)向PDAC的演变起着关键作用。在小鼠模型中,降低或缺失PIKfyve的表达能显著减少肿瘤负荷,保留更多正常胰腺组织结构,并显著降低肿瘤的发生率和恶性程度。这强有力地表明,PDAC细胞对PIKfyve存在显著依赖性,抑制PIKfyve有望成为一种治疗策略。

图1 PIKfyve对于前体PanIN病变发展为PDAC至关重要
二、药物抑制PIKfyve有效阻断胰腺癌进展
基于基因研究的结果,研究人员进一步评估了药物抑制PIKfyve的效果。实验证实,PIKfyve抑制剂apilimod和ESK981能有效结合并抑制PIKfyve的活性。在小鼠模型中进行的预防性治疗和移植瘤模型研究显示,使用PIKfyve抑制剂ESK981能够显著抑制PDAC的发展和生长,同时小鼠对药物表现出良好的耐受性,体重未受影响。这提示PIKfyve抑制剂具有潜在的临床应用价值。

图2 药物抑制PIKfyve可阻断胰腺癌在体内的进展
三、PIKfyve抑制迫使PDAC细胞依赖新生脂肪合成
深入的代谢分析揭示了PIKfyve在PDAC细胞代谢中的重要作用。抑制PIKfyve会导致溶酶体功能障碍和胆固醇积累,进而诱导癌细胞上调胆固醇稳态、mTORC1信号和脂肪酸代谢相关基因。癌细胞为了应对PIKfyve抑制造成的代谢失衡,被迫高度依赖于从头合成脂质(新生脂肪合成)来维持生存。这一发现为靶向PIKfyve的代谢疗法提供了理论基础。

图3 抑制PIKfyve使PDAC细胞刺激脂肪生成转录和代谢程序
四、联合KRAS-MAPK抑制剂实现协同抗癌效应
研究进一步探索了同时靶向PIKfyve和KRAS-MAPK通路的效果。已知KRAS-MAPK信号通路是PDAC细胞中新生脂肪合成的主要驱动因素。实验发现,单独抑制PIKfyve会上调脂肪合成相关基因,而同时抑制PIKfyve和KRAS-MAPK通路(使用MEK抑制剂trametinib或selumetinib)则能减弱这种上调,并进一步干扰脂质代谢。在多种临床前PDAC模型中,PIKfyve抑制剂与MEK抑制剂联合治疗显示出显著的协同效应,能够完全或几乎完全消除肿瘤负荷,大幅延长小鼠生存期,远优于单药治疗。这表明PIKfyve和KRAS-MAPK之间存在“合成致死”关系,双重抑制能使PDAC细胞陷入无法弥补的代谢危机。

图4 KRAS-MAPK和PIKfyve双重抑制导致PDAC的代谢危机和协同生长抑制
结论与展望
这项研究提出了通过靶向PIKfyve来破坏PDAC溶酶体功能的新策略。研究发现,PIKfyve抑制会迫使癌细胞依赖新生脂肪合成,而KRAS-MAPK通路正是这一过程的关键驱动者。因此,同时抑制PIKfyve和KRAS-MAPK通路,能够切断癌细胞获取必需脂质的途径,导致其代谢崩溃,实现协同杀伤。鉴于目前KRAS、泛KRAS和MAPK通路抑制剂的快速发展,以及PIKfyve抑制剂ESK981已进入多中心II期临床试验(NCT05988918),这种联合治疗策略极具前景,有望快速转化为临床应用,为胰腺癌患者带来新的治疗希望。
对于胰腺癌患者而言,寻找有效的抗癌药和靶向药至关重要。了解最新的药物信息和临床研究进展,有助于患者及其家属做出更明智的治疗决策。许多海外新药或仿制药可能通过海外购药渠道获取。面对复杂的癌症信息和治疗选择,患者可以通过AI问诊服务获取初步的专业建议,或查阅药物信息和诊疗指南等抗癌资讯。
原文链接:
https://www.nature.com/articles/s41586-025-08917-z