免疫检查点抑制剂的问世为癌症治疗带来了革命性的变化,已成为多种恶性肿瘤的标准疗法。然而,对于胰腺癌,尤其是胰腺导管腺癌(PDAC)和胰腺神经内分泌肿瘤(PNETs),免疫治疗的疗效却十分有限,大多数患者难以从中获益。这使得寻找能够预测免疫治疗应答的生物标志物变得尤为重要。
近期有研究报告了两例经传统治疗无效或复发的晚期胰腺癌患者。研究人员对患者的肿瘤组织进行了基因测序和PD-L1表达分析,并评估了综合阳性评分(CPS)和肿瘤突变负荷(TMB)等潜在的预测性指标。基于这些评估结果,患者接受了免疫检查点阻断治疗,并意外地获得了持久的影像学缓解。这一发现提示,对于难治性或复发性胰腺癌患者,在考虑免疫检查点抑制剂治疗前,进行CPS和TMB评估或许具有临床价值,有助于筛选出潜在的获益人群。
背景解读:胰腺癌为何难响应免疫治疗?
胰腺恶性肿瘤,如PDAC和PNETs,一旦发展至全身转移阶段,通常难以治愈。与某些对免疫治疗高度敏感的肿瘤不同,胰腺癌对免疫检查点阻断(ICB)治疗普遍存在抵抗性。这背后原因复杂,其中一个重要因素是肿瘤内部缺乏足够的细胞毒性T细胞(CTL)浸润,即所谓的“冷肿瘤”特性。
尽管科学家们正在积极探索多种预测ICB疗效的生物标志物,但目前尚无一个被广泛认可的指标来精准预测胰腺癌对免疫治疗的反应。因此,当前的策略是借鉴在其他对ICB更敏感的肿瘤中已有的生物标志物,如基于免疫组化评估PD-L1表达的综合阳性评分(CPS)和肿瘤阳性比例评分(TPS),以及反映基因突变数量的肿瘤突变负荷(TMB)。高TMB已被证明在晚期实体瘤中与ICB疗效相关。
本文报告的两例胰腺恶性肿瘤病例,其共同点在于都表现出阳性的TPS/CPS或高TMB(TMB-H),并且在接受ICB治疗后取得了显著且持续的临床缓解。第一例患者是晚期PDAC,出现远处转移后检测到高TPS/CPS;第二例患者是转移性PNET,其TMB-H状态促使临床医生尝试免疫治疗。这两个案例为在通常对ICB无应答的胰腺癌类型中,探索TPS/CPS和TMB-H作为预测指标提供了初步证据。
对于希望了解更多靶向药、抗癌药信息或寻求海外购药途径的患者及家属,可以访问MedFind海外靶向药代购平台,获取专业的药物资讯和代购服务。
病例分析:PD-L1高表达与高TMB的获益案例
病例1:晚期胰腺导管腺癌伴肺转移
一位77岁男性患者,初诊为IIB期胰腺导管腺癌,接受了新辅助化疗、放化疗及手术等综合治疗。术后两年多出现多发性肺部转移复发。在卡培他滨治疗期间因并发症停药后,肿瘤负荷增加。对肺部转移灶活检进行基因测序和PD-L1免疫组化检测,结果显示PD-L1综合阳性评分(CPS)高达40,肿瘤阳性比例评分(TPS)为40%,且存在CDH1基因功能缺失。基于转移灶的高CPS/TPS状态,患者开始接受帕博利珠单抗(Pembrolizumab)单药治疗。
令人欣喜的是,患者对帕博利珠单抗耐受良好,治疗7个周期后随访影像显示肺部转移灶数量和大小显著减少,腹部及盆腔转移灶消失。尽管在治疗一年后出现疾病进展迹象,但患者仍持续接受帕博利珠单抗治疗并定期监测。此案例提示,即使是通常对免疫治疗不敏感的PDAC,高PD-L1表达可能预示着对帕博利珠单抗的潜在应答。

▲图1 病例1的治疗时间线
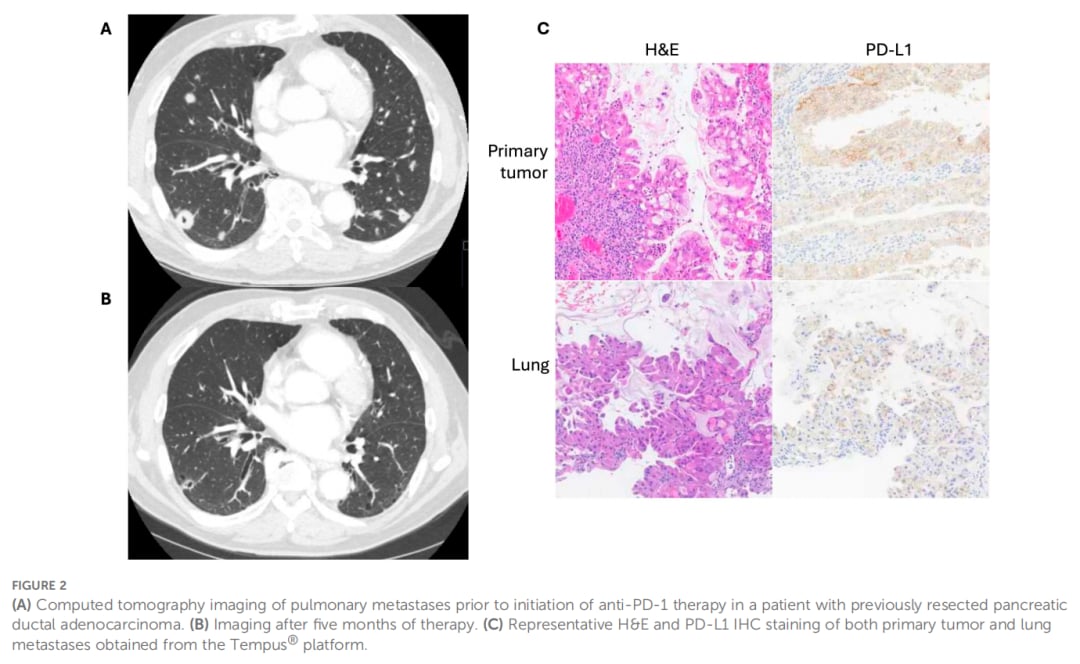
▲图2 影像学结果和病理结果
病例2:转移性胰腺神经内分泌肿瘤伴高TMB
另一位63岁女性患者,因腹痛等症状就诊,被诊断为转移性胰腺神经内分泌肿瘤(PNET),肿瘤巨大并侵犯周围血管。患者初始接受奥曲肽治疗,后因疾病进展加用依维莫司。尽管治疗方案调整,疾病仍有进展迹象。
对患者肿瘤样本进行下一代测序,检测到TP53和TSC2基因突变,更重要的是,肿瘤突变负荷(TMB)高达10.5 muts/Mb,处于高水平(排位89%)。尽管此时PD-L1表达为阴性,但基于高TMB状态,在继续奥曲肽和依维莫司治疗的基础上,加用了帕博利珠单抗。
联合治疗带来了转机。启动帕博利珠单抗治疗6个月后,影像学检查显示胰腺原发肿瘤及门静脉周围淋巴结均较前缩小,9个月时肿瘤体积进一步减小。截至本文撰写时,患者接受帕博利珠单抗治疗已超过两年,疾病仍维持控制状态。此案例表明,对于PNET,即使PD-L1阴性,高TMB也可能预示着对免疫治疗的良好应答。

▲图3 病例2的治疗时间线
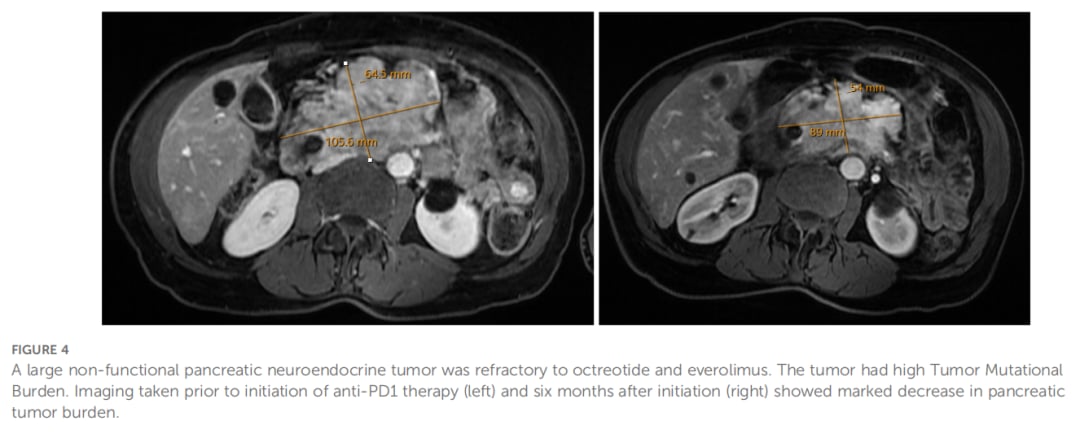
▲图4 胰腺神经内分泌肿瘤对奥曲肽和依维莫司具有耐药性
如果您或家人正面临胰腺癌等恶性肿瘤的治疗选择,对帕博利珠单抗等靶向药、抗癌药感兴趣,并希望了解海外购药或代购的流程和价格,可以访问MedFind的药品商城获取更多信息。同时,您也可以尝试使用MedFind的AI问诊服务,获取初步的个性化诊疗建议。
深入探讨:生物标志物与胰腺癌免疫微环境
尽管胰腺癌对ICB应答率低(PDAC患者获益率不足5%),但确实存在一小部分患者能够从中获益。因此,在PDAC和PNET患者中寻找更有效的预测指标至关重要。本文报告的病例提示,即使在错配修复功能完整的情况下,高CPS/TPS或高TMB的胰腺癌患者仍可能从ICB治疗中获得显著益处。
TMB作为反映肿瘤基因组突变频率的指标,与肿瘤免疫原性相关,可能预测PD-L1阻断疗效。虽然PDAC和PNET中TMB-H的比例极低,但部分研究表明,TMB-H的PDAC患者可能具有更强的抗肿瘤免疫活性。Keynote-158研究也前瞻性分析了TMB-H与帕博利珠单抗疗效的关系,结果显示,无论癌种如何,TMB-H患者接受帕博利珠单抗治疗后的无进展生存期均优于低TMB患者。
肿瘤免疫微环境是影响ICB疗效的关键因素。PDAC通常被视为免疫学“冷肿瘤”,缺乏活跃的CTL浸润。这种免疫抑制状态与多种因素有关,包括髓系细胞浸润、调节性T细胞(Treg)富集、肿瘤基质特性等。未来,探索如何将胰腺癌从“冷肿瘤”转化为“热肿瘤”,以及评估CTL数量等指标,可能有助于更精准地预测ICB疗效。
此外,疾病复发和转移的部位也可能影响胰腺癌ICB疗效。病例1患者仅出现孤立性肺转移,这在PDAC术后复发中相对少见,但回顾性研究显示,孤立性肺转移患者的生存期显著优于其他转移模式(如肝转移)。尽管本例患者的高CPS状态可能预测了ICB疗效,但转移部位是否也发挥了作用,以及肝转移患者是否也能获得类似益处,仍需进一步研究。
研究局限与展望
本文的主要局限性在于其回顾性研究性质和极小的样本量(仅两例)。这使得研究结果无法直接推广到所有难治性胰腺癌患者群体,也难以进行统计学分析。同时,无法确定伴随的其他基因突变是否影响了免疫治疗效果,以及孤立性肺转移在病例1的良好应答中扮演了多大角色。
尽管存在局限,但这两例病例为我们提供了重要的启示:在常规治疗无效的复发性胰腺癌患者中,评估PD-L1表达(CPS/TPS)和肿瘤突变负荷(TMB)是合理且有价值的。这些生物标志物有望帮助临床医生筛选出可能从免疫检查点抑制剂治疗中获益的患者亚群,从而实现更精准的治疗决策。未来的前瞻性研究需要进一步验证这些生物标志物的预测价值,并探索更多潜在的预测指标,为胰腺癌患者带来更多治疗希望。
了解更多关于胰腺癌的诊疗信息、药物选择或寻求海外购药支持,欢迎访问MedFind抗癌资讯平台。