引言:精准医疗时代,基因检测为何如此重要?
随着现代医学,特别是基因组学技术的飞速发展,我们对肿瘤的认识已经深入到分子层面。对于中枢神经系统(CNS)肿瘤,如脑胶质瘤、髓母细胞瘤等,传统的病理诊断已不足以完全指导治疗。如今,基因检测技术(如NGS二代测序)已成为不可或令的环节,它能揭示肿瘤独特的遗传背景,为医生和患者在肿瘤分类、预后判断和治疗方案选择上提供关键的科学依据。
那么,针对几种常见的中枢神经系统肿瘤,基因检测具体能带来哪些指导意义呢?
一、脑胶质瘤:基因检测的指导意义
作为最常见的原发性颅内恶性肿瘤,脑胶质瘤的治疗正从“一刀切”的传统模式向“个体化”的精准治疗转变。基因检测在其中扮演着核心角色。
精准分型与预后判断
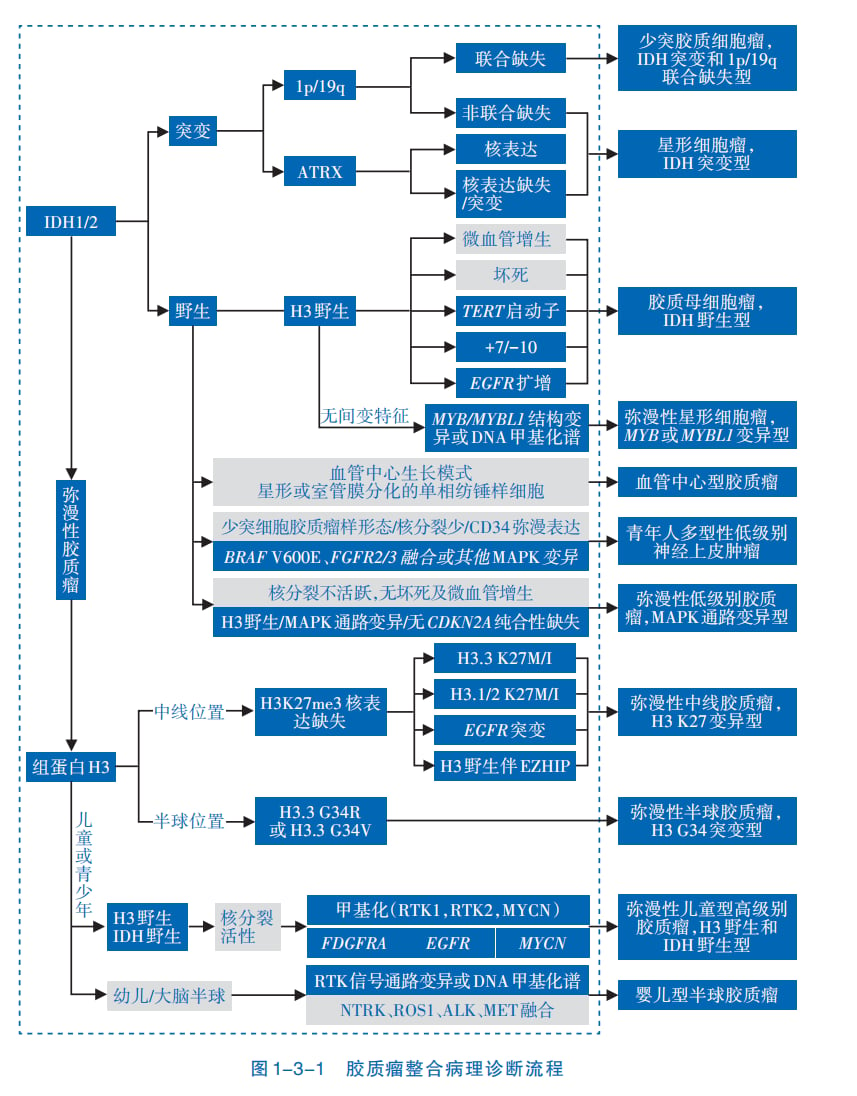
根据《2021版WHO中枢神经系统肿瘤分类》,成人弥漫性胶质瘤的诊断必须结合分子标记物。IDH突变和1p/19q共缺失是关键的分型指标,直接将胶质瘤划分为星形细胞瘤(IDH突变型)、少突胶质细胞瘤(IDH突变和1p/19q共缺失型)和胶质母细胞瘤(IDH野生型)三大类。此外,如CDKN2A/B纯合缺失可将IDH突变型星形细胞瘤直接升级为恶性程度最高的WHO 4级,而TERT启动子突变则对判断预后有重要价值。
指导靶向与免疫治疗
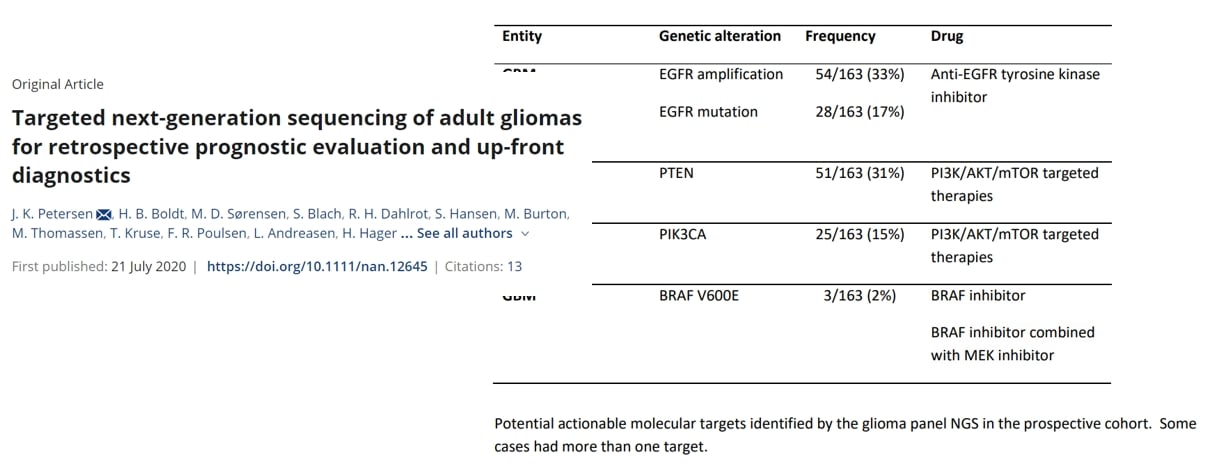
基因检测能够发现潜在的“用药靶点”。研究显示,超过半数的胶质母细胞瘤患者存在可被药物干预的分子靶点。例如,PTPRZ1-MET(ZM)融合、NTRK融合、FGFR变异、IDH突变等,都对应着潜在的靶向治疗机会。同时,PD-L1表达、微卫星不稳定性(MSI)等指标则能预测免疫治疗的疗效。因此,进行全面的基因检测是制定脑胶质瘤个体化治疗方案、精准判断预后的基石。









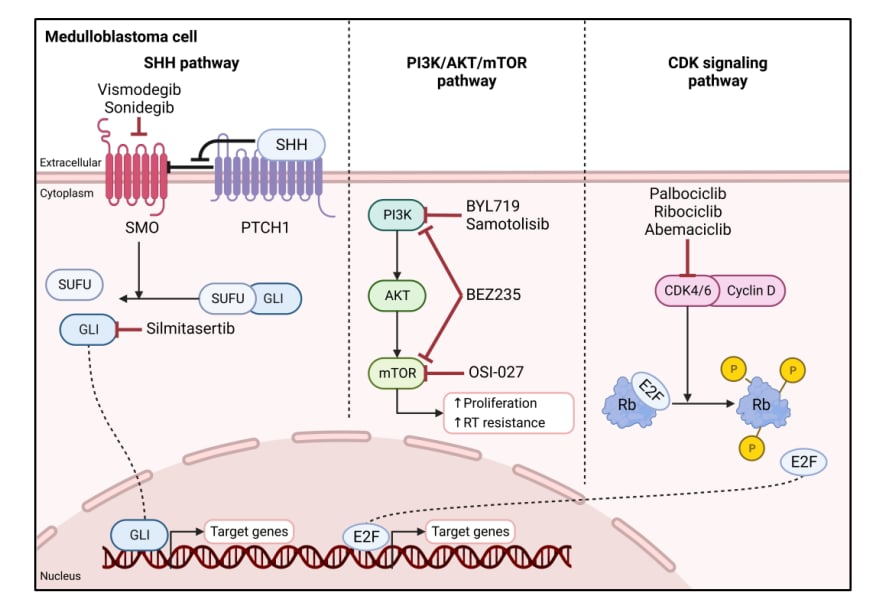
二、髓母细胞瘤:基因检测的指导意义
髓母细胞瘤(MB)是儿童中最常见的恶性胚胎性肿瘤。基因检测对于其诊疗同样至关重要。
分子分型与风险评估
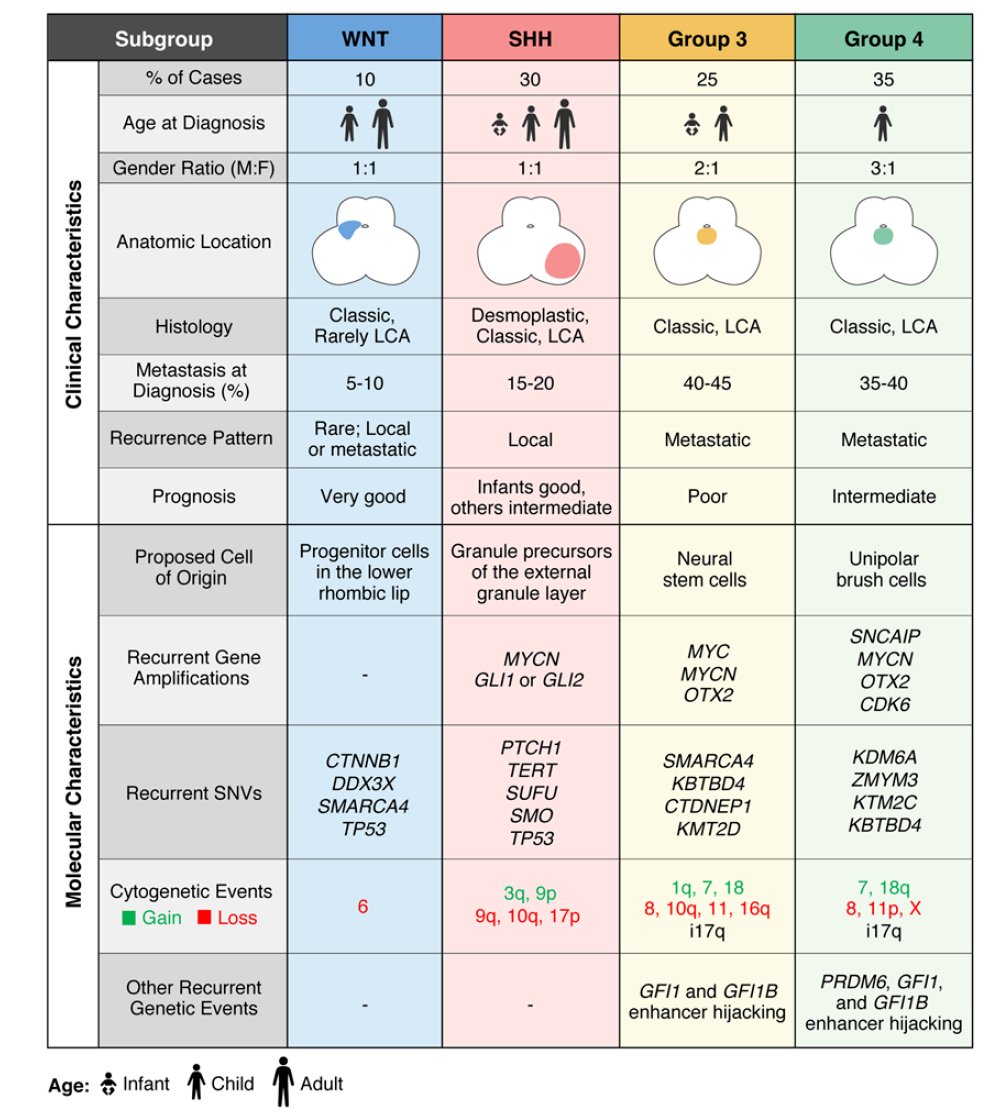
国际共识已将髓母细胞瘤分为四大分子亚型:WNT型、SHH型、Group3和Group4。不同亚型的预后和治疗策略差异巨大。例如,WNT型预后最好,而Group3(常伴有MYC扩增)预后最差。通过基因检测明确分子分型,结合临床信息,可以将患者分为低、标、高、极高危组,从而实现“减毒增效”的个体化放化疗。
指导靶向治疗与遗传筛查
对于携带SHH通路相关基因突变(如PTCH1失活突变)的成人髓母细胞瘤患者,NCCN指南推荐可考虑使用靶向药物维莫德吉(Vismodegib)进行治疗。此外,约5%的患者存在遗传背景,检测APC、TP53等基因有助于家族遗传风险的评估和早期干预。








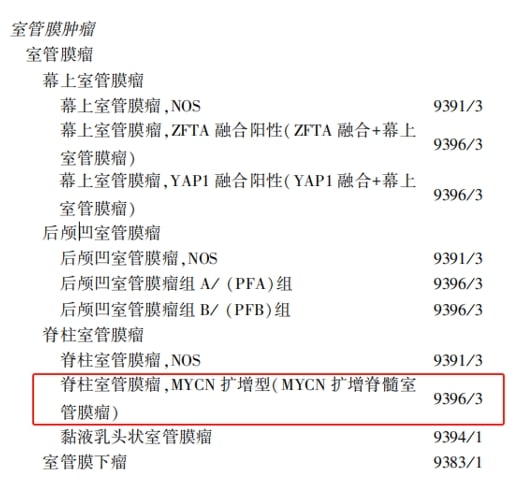
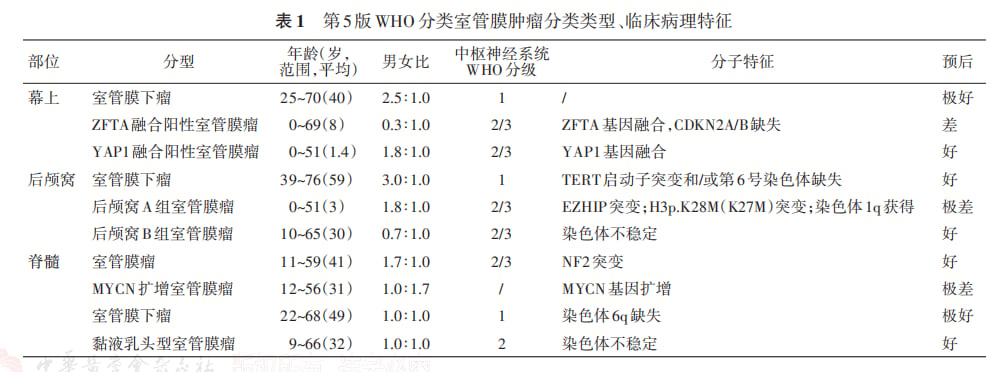
三、室管膜瘤:基因检测的指导意义
室管膜瘤的诊断和治疗同样依赖于分子特征的识别。关键的分子变异包括ZFTA融合和MYCN扩增。
NCCN指南推荐检测ZFTA和YAP1融合。其中,ZFTA融合阳性的幕上室管膜瘤已被WHO定义为一个独特的、侵袭性更强的亚型。而MYCN扩增的脊髓室管膜瘤同样具有高侵袭性。识别这些高危分子特征,有助于医生制定更积极的治疗策略,并探索新的靶向治疗可能。值得一提的是,对于室管膜瘤等疑难病例,全基因组DNA甲基化分层分析正成为一种极其有用的诊断工具。





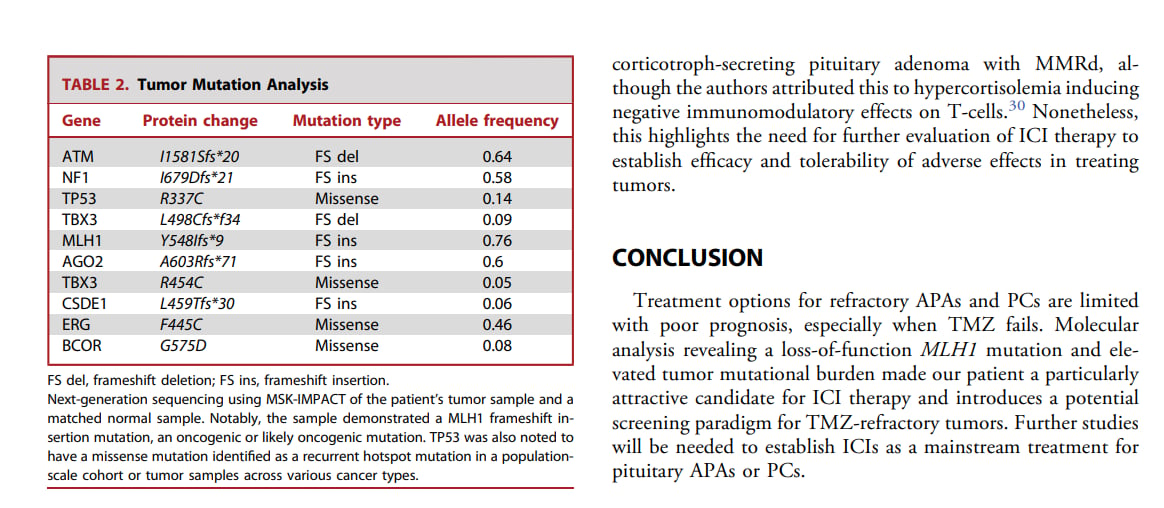
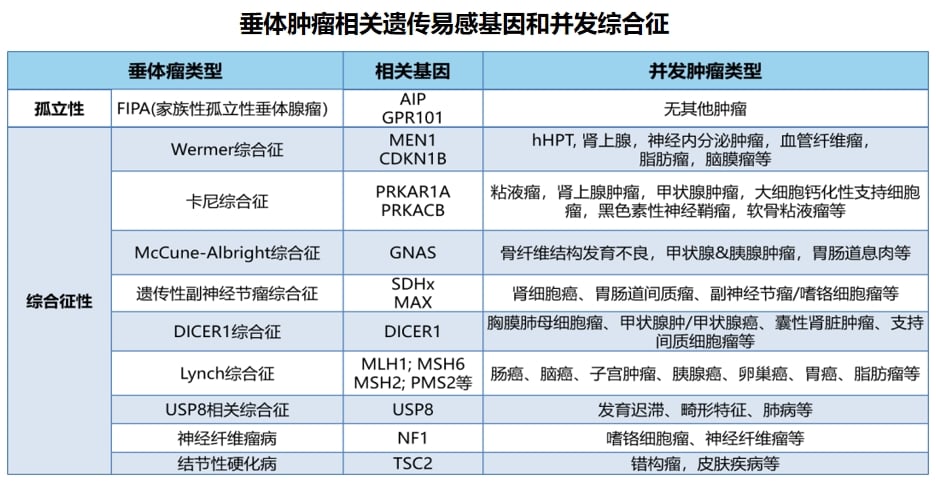
四、垂体瘤:基因检测的指导意义
多数垂体瘤为良性,但部分侵袭性垂体瘤对标准治疗耐药,预后差。对于这类难治性垂体瘤,基因检测尤为关键。
化疗药物替莫唑胺(Temozolomide)是难治性垂体腺瘤和垂体腺癌的一线治疗选择。此外,基因检测可以发现RAF/MEK/ERK、PI3K/Akt/mTOR等信号通路的异常激活,为寻找新的靶向治疗方案提供线索。已有案例显示,携带MMR基因突变、高肿瘤突变负荷(TMB-H)的患者可能从免疫检查点抑制剂治疗中获益。对于有家族史或年轻患者,检测MEN1、AIP等遗传性基因,对评估遗传风险和指导长期管理至关重要。







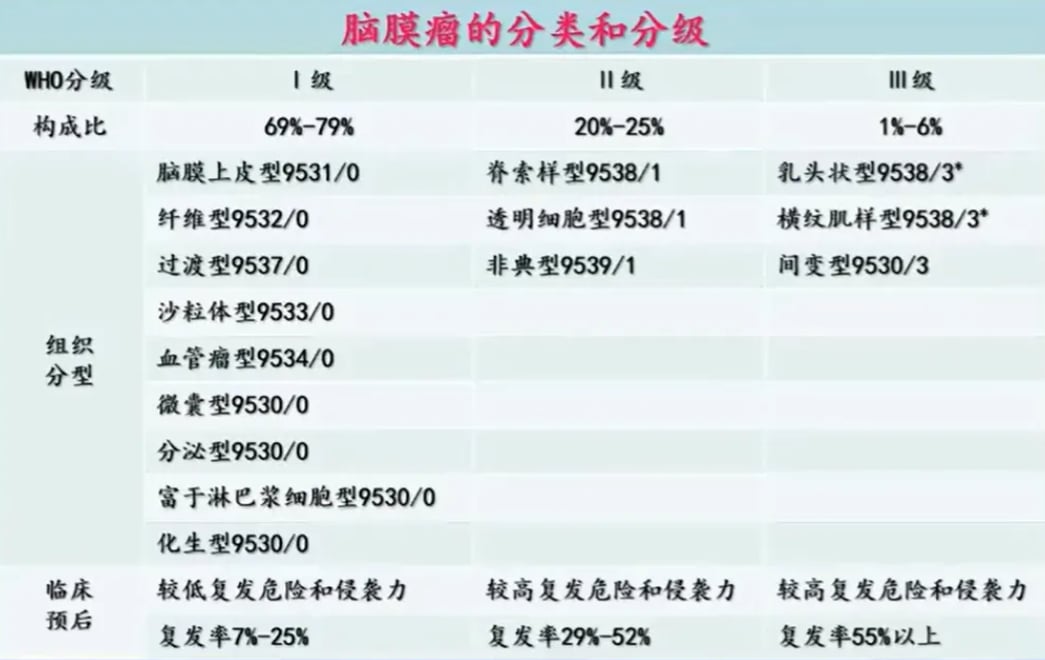
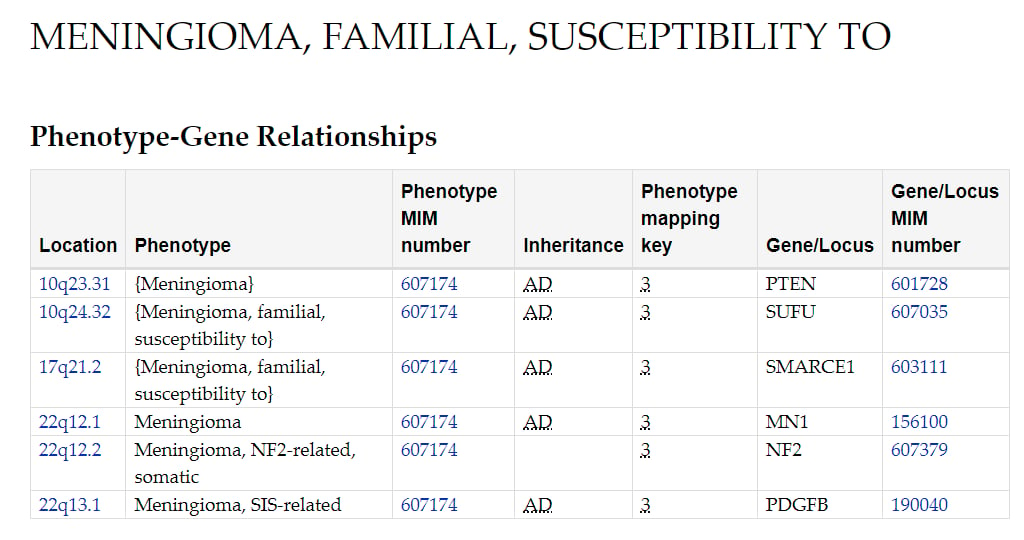
五、脑膜瘤:基因检测的指导意义
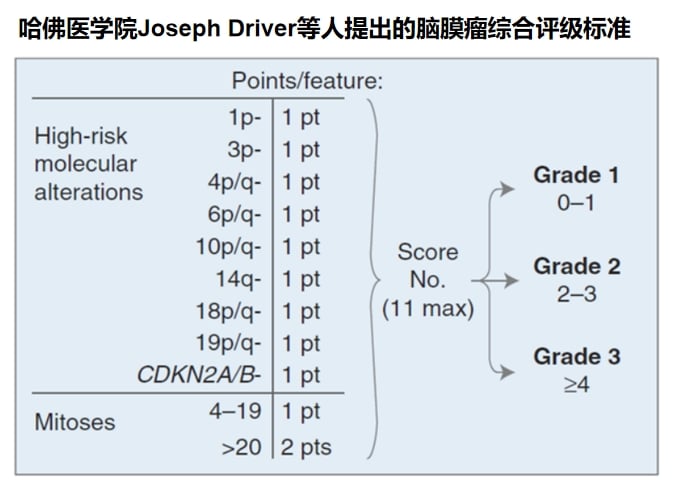
脑膜瘤的分子病理特征与其恶性级别和临床预后密切相关。2021年WHO分类首次将分子特征纳入其分级标准。
精准分级与预后预测
基因检测结果可以直接影响脑膜瘤的分级。例如,一旦检测到TERT启动子突变或CDKN2A/B纯合性缺失,无论其病理形态如何,都应直接判定为恶性程度最高的WHO 3级。这对于准确评估复发风险、制定后续治疗和随访计划至关重要。
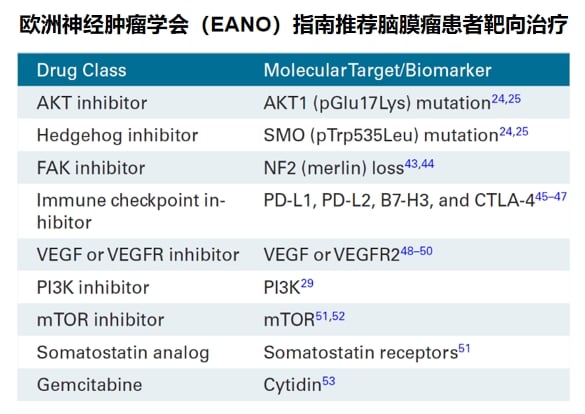
指导靶向治疗选择
基因检测同样为脑膜瘤的药物治疗开辟了新途径。根据《欧洲神经肿瘤学会脑膜瘤诊治指南》,若检出AKT1、SMO、NF2、PIK3CA等基因突变,患者可能从相应的靶向治疗中获益。分子检测正推动脑膜瘤的诊疗进入“分子-病理”整合诊断的新阶段,为实现精准治疗提供关键支撑。