胰腺癌因其高恶性度、治疗手段有限以及不足5%的五年生存率,一直被视为“癌中之王”,其中胰腺导管腺癌(PDAC)最为常见且致命。究竟是什么因素驱动并维持着胰腺癌细胞的高度恶性?近日,一项发表在国际顶级期刊《自然》(Nature)上的研究为我们揭示了答案。
胰腺癌治疗的挑战:肿瘤异质性
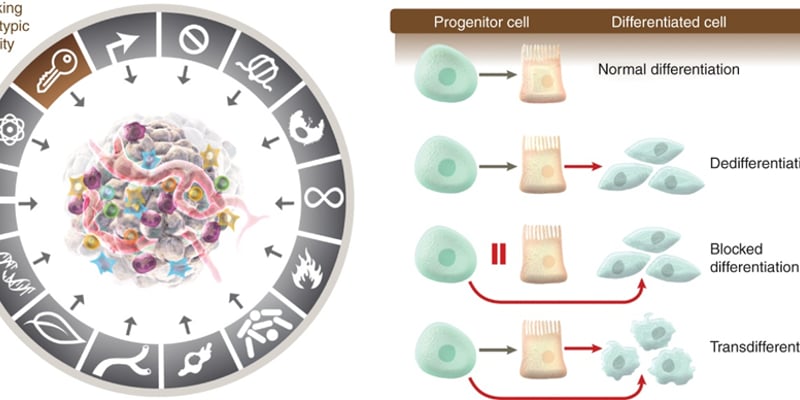
胰腺癌的治疗之所以困难重重,其高度的异质性和复杂的肿瘤微环境是主要原因。在胰腺肿瘤中,存在两种主要的细胞亚群:一类是相对“温和”的上皮样肿瘤细胞,另一类则是侵袭性强、易转移且高度耐药的间质样肿瘤细胞。后者是导致胰腺癌治疗失败和预后极差的“罪魁祸首”。如何有效控制这类恶性细胞,是攻克胰腺癌的关键。
关键调控因子被发现:骨桥蛋白(SPP1)
由中山大学附属第七医院张常华教授团队领衔的国际合作研究,首次揭示了骨桥蛋白(Osteopontin, SPP1)在调控胰腺癌细胞命运中的决定性作用。研究团队通过对比早期与晚期胰腺癌患者的血液样本,发现晚期患者血液中的SPP1水平显著升高,并且这与肿瘤的恶性转化进程密切相关。
为了验证SPP1的关键作用,研究人员在高度模拟人类肿瘤的小鼠胰腺癌类器官模型中,特异性地“敲除”了产生SPP1的基因。结果令人振奋:一旦SPP1基因失活,那些恶性程度高的间质性肿瘤细胞便大量减少,类器官在小鼠体内的成瘤和转移能力也随之显著下降。这一发现为开发全新的胰腺癌靶向药物开辟了道路。如果您想了解更多关于胰腺癌靶向治疗的最新资讯或有购药需求,可以访问MedFind抗癌资讯获取帮助。
揭示作用机制:一个精密的反馈调节网络
研究团队进一步深入探索,精准绘制出了胰腺癌细胞间的“对话网络”。原来,肿瘤中的上皮细胞和间质细胞通过分泌不同的蛋白进行“沟通”,维持着整个肿瘤的动态平衡和恶性进展。具体来说:
- 上皮肿瘤细胞分泌的SPP1作为关键信使,与间质肿瘤细胞表面的CD61受体结合。
- 这一结合激活了下游信号,促使间质细胞产生更多的BMP2和GREM1蛋白。
- 而GREM1蛋白又会反过来作用于上皮细胞,帮助其维持特性。
至此,SPP1、BMP2和GREM1三者构成了一个精密的反馈调节网络,共同决定了胰腺癌细胞的“双重身份”及其整体的恶性程度。

临床转化潜力:靶向SPP1的治疗前景
基于以上发现,研究团队验证了靶向SPP1的治疗效果。他们使用靶向SPP1的单克隆抗体药物来治疗患有胰腺癌的小鼠模型。结果显示,治疗组小鼠的生存期显著延长,肿瘤转移也得到了有效控制。对于癌症治疗中遇到的任何问题,无论是新药信息还是治疗方案,都可以通过MedFind AI问诊获得专业解答。
尤为重要的是,SPP1是一种分泌到细胞外的蛋白,这使得抗体药物更容易靶向它,且潜在的副作用可能更小。因此,靶向SPP1的治疗策略具有极高的临床转化潜力,为胰腺癌的精准治疗开辟了全新的靶点。

这项研究不仅突破了以往仅针对上皮细胞的传统治疗思路,更为未来开发针对肿瘤微环境的新型胰腺癌治疗策略提供了坚实的理论与实验依据。虽然靶向骨桥蛋白的药物仍在研发中,但目前已有多种靶向药可用于其他癌症治疗。如需了解相关药物的购买渠道和价格,欢迎访问MedFind全球靶向药代购平台。