胰腺癌,因其极高的致死率和严峻的预后,常被称为“癌症之王”。数据显示,未经治疗的患者中位生存期仅有短短3-5个月,即使接受了手术切除,平均生存时间也往往难以超过20个月 (1-4)。胰腺癌的诊断通常较晚,发现时多已处于晚期并伴随远处转移,加之其高度侵袭性,使得根治性手术的机会大大减少 (5),这些都是导致其预后不佳的关键因素。
流行病学研究指出,吸烟是胰腺癌最明确的风险因素之一,可将患病风险提高2-3倍 (6-7)。同时,慢性胰腺炎、长期酗酒等也被认为是胰腺癌发病的相关因素 (8)。从病理类型来看,绝大多数胰腺癌属于导管腺癌,且好发于胰头部位。
尽管传统化疗的应用已将胰腺癌患者的五年生存率从世纪初的约5%提升至近10% (9-11),但这对于攻克“癌王”仍远远不够。幸运的是,随着二代测序(NGS)技术和分子病理学的飞速发展,精准医学为胰腺癌治疗带来了革命性的变化。现在,患者可以通过肿瘤组织测序寻找特定的靶向治疗位点,或进行胚系突变检测为家人提供遗传风险评估。这些先进的检测技术为制定高度个体化的治疗方案奠定了基础。本文将重点介绍胰腺癌靶向治疗的最新进展,探索精准医学时代下的治疗新策略。
胰腺癌的关键分子特征
胰腺癌的发生发展与多种基因突变密切相关,这些突变可以是遗传性的(胚系突变),也可以是后天获得的(体细胞突变)。体细胞突变在肿瘤进展中扮演着尤为重要的角色。以下是一些最常见的驱动基因突变(如表1所示):
· KRAS:突变率超过90%,导致RAS信号通路持续激活,刺激肿瘤细胞无节制增殖并帮助其逃避免疫系统的监视。
· TP53:约75%的胰腺癌患者存在TP53功能丧失性突变,这使得细胞失去了重要的生长抑制机制。
· SMAD4 和 CDKN2A:这两种抑癌基因的突变也相当普遍,主要影响TGF-β信号通路,进一步促进肿瘤恶化。
· DNA修复基因(如BRCA1, BRCA2, ATM, PALB2):虽然突变率相对较低,但携带这些基因突变的患者往往对特定药物,如PARP抑制剂(如奥拉帕利)和铂类化疗药物(如顺铂、奥沙利铂)更为敏感。
除了基因突变,表观遗传学改变(例如CDKN2A基因启动子区域的甲基化)等其他分子层面的异常也在胰腺癌的发生发展中发挥着作用。理解这些复杂的分子机制是开发和应用靶向治疗药物的基础。对于希望深入了解自身基因检测报告或探讨治疗方案的患者,可以考虑使用MedFind AI问诊服务获取初步解读和建议。
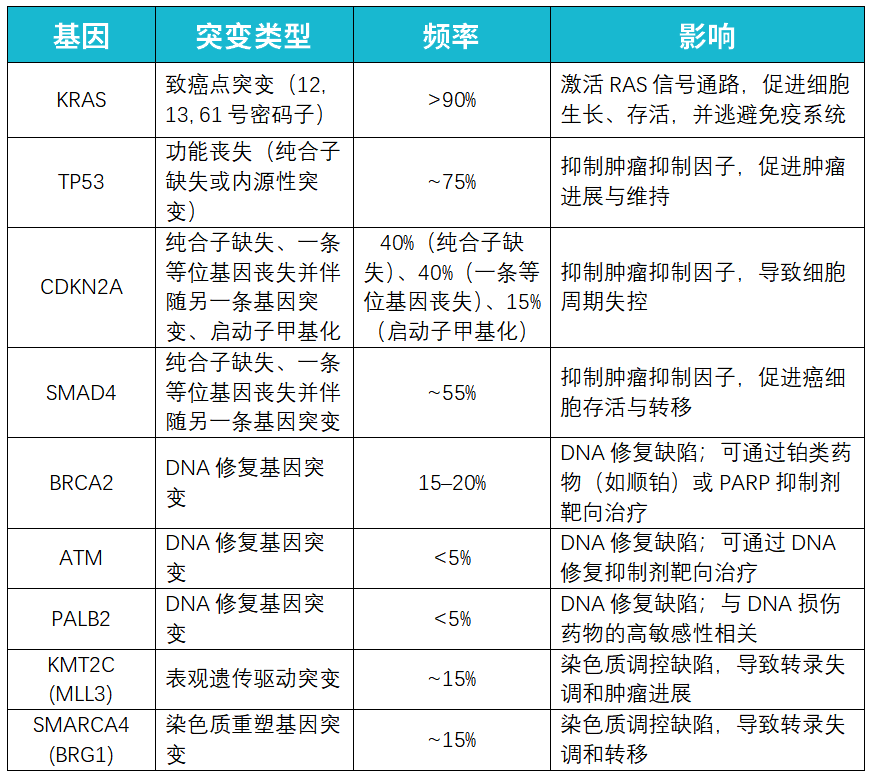
表1: 胰腺癌的常见基因突变。
胰腺癌靶向治疗的突破与进展
靶向治疗的核心理念是“对因下药”——根据肿瘤独特的基因或分子特征来选择最有效的治疗药物。目前,美国FDA已批准多种用于治疗携带特定分子标记的胰腺癌的靶向药物(如表2所示)。
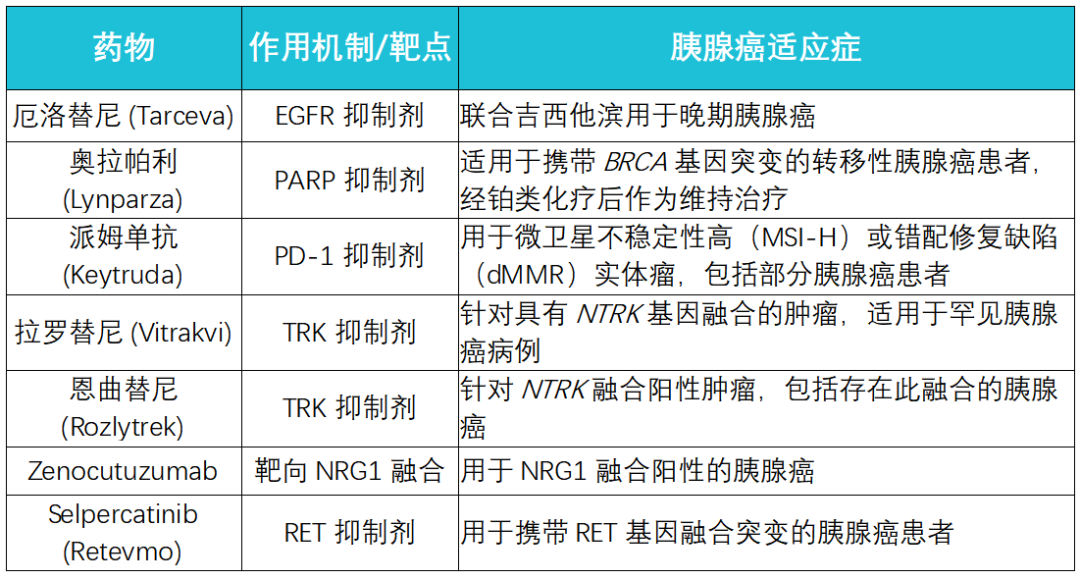
表2: FDA批准的部分胰腺癌靶向药物。
1. 针对BRCA1/2或PALB2突变:PARP抑制剂疗法
· 对于携带BRCA1/2或PALB2胚系突变的胰腺癌患者,铂类化疗(如顺铂、奥沙利铂)通常作为一线治疗选择,其有效率可达50-80%,显著优于无此类突变的患者,中位总生存期可达约22个月 (12)。
· 奥拉帕利 (Olaparib) 是一种PARP抑制剂。它利用了“合成致死”原理,在BRCA突变的肿瘤细胞中,DNA修复能力本已受损,奥拉帕利能进一步阻断另一条修复通路(PARP通路),从而导致癌细胞DNA损伤累积至无法修复而凋亡。POLO III期临床试验显示,对于铂类化疗后病情稳定的BRCA突变晚期胰腺癌患者,使用奥拉帕利维持治疗可显著延长无进展生存期(PFS),但总生存期(OS)与安慰剂组相比无显著差异 (13)。获取奥拉帕利这类靶向新药可能面临挑战,患者可以关注MedFind靶向药代购平台,了解相关药物的价格和购买途径,包括潜在的仿制药信息。
2. 针对MSI-H或dMMR:免疫检查点抑制剂
· 微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)在胰腺癌中较为罕见,发生率低于2%。然而,这类患者对PD-1抑制剂,如帕姆单抗 (Pembrolizumab, 商品名Keytruda),表现出非常好的治疗反应 (14)。
· 免疫检查点抑制剂(ICIs)通过阻断PD-1/PD-L1等信号通路,重新激活患者自身的T细胞,使其能够识别并攻击肿瘤细胞。对于符合条件的患者,免疫治疗提供了一种全新的、有效的治疗选择。
3. 针对NTRK基因融合:广谱抗癌药显身手
· NTRK基因融合是另一种罕见的驱动基因改变(在胰腺癌中发生率<1%),但它是一个明确的治疗靶点。
· 拉罗替尼 (Larotrectinib) 和恩曲替尼 (Entrectinib) 是两种“不限癌种”的靶向药,专门抑制由NTRK基因融合产生的异常TRK蛋白激酶活性。对于携带NTRK融合的胰腺癌患者,这两种药物能带来显著的治疗获益。
4. 针对RET基因融合:特异性RET抑制剂
· RET基因融合同样罕见,但它会导致RET酪氨酸激酶持续激活,驱动肿瘤生长。
· 塞尔帕替尼 (Selpercatinib) 是一种高选择性的RET抑制剂。在LIBRETTO-001篮子试验中,针对包括胰腺癌在内的多种RET融合阳性实体瘤患者,塞尔帕替尼展现了超过50%的客观缓解率(ORR),使其成为这类患者的重要治疗选择 (15)。
5. 针对NRG1基因融合:靶向HER3的新策略
· NRG1基因融合的发生率约为3%,它会导致NRG1蛋白异常表达,进而过度激活HER2-HER3信号通路。
· Zenocutuzumab 是一种创新的双特异性抗体,能够同时结合HER2和HER3,有效阻断NRG1与HER3的结合。临床研究显示,在NRG1融合阳性的胰腺癌患者中,Zenocutuzumab的客观缓解率(ORR)达到了40% (16)。
6. 精准匹配提升生存获益
· 近期一项研究再次印证了基于基因组信息的靶向治疗在晚期胰腺癌中的价值。研究人员根据患者肿瘤基因组特征与靶向药物的匹配程度进行评分(GMS)。结果显示,GMS评分高(≥50%)的患者,其中位总生存期(OS)达到6.8个月,无进展生存期(PFS)为3.9个月,显著优于GMS评分较低(<50%)患者的3.3个月OS和1.8个月PFS (17)。这强调了进行全面的基因检测以指导精准治疗的重要性。
总结与未来展望
分子病理学的进步彻底改变了我们对胰腺癌的认识,推动了治疗模式从传统的“一刀切”化疗向基于分子分型的精准治疗转变。针对BRCA1/2、PALB2、MSI-H、NTRK、RET、NRG1等特定分子靶点的个性化治疗方案,正为越来越多的胰腺癌患者带来新的生机。
然而,胰腺癌高度的异质性仍然是治疗中的巨大挑战。未来,我们需要进一步加强多组学研究,深入理解肿瘤的复杂性,并据此开发更多、更有效的靶向药物和联合治疗策略。持续开展设计良好的临床试验,不断优化精准医疗的应用,将是未来攻克胰腺癌的关键所在。对于寻求最新治疗方案和药物信息的患者,关注MedFind抗癌资讯,或通过海外靶向药代购渠道了解药物可及性,都是积极应对疾病的可行途径。
参考文献
1. Conlon KC, Klimstra DS, Brennan MF. Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg. 1996 Mar;223(3):273-9.
2. Neoptolemos JP, Stocken DD, Dunn JA, et al. Influence of resection margins on survival for patients with pancreatic cancer treated by adjuvant chemoradiation and/or chemotherapy in the ESPAC-1 randomized controlled trial. Ann Surg. 2001 Dec;234(6):758-68.
3. Kuhlmann KF, de Castro SM, Wesseling JG, et al. Surgical treatment of pancreatic adenocarcinoma; actual survival and prognostic factors in 343 patients. Eur J Cancer. 2004 Mar;40(4):549-58.
4. Matsuno S, Egawa S, Fukuyama S, et al. Pancreatic Cancer Registry in Japan: 20 years of experience. Pancreas. 2004 Apr;28(3):219-30.
5. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7– 33.
6. Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011; 364(19):1817–1825.
7. Iodice S, Gandini S, Maisonneuve P, Lowenfels AB. Tobacco and the risk of pancreatic cancer: a review and meta-analysis. Langenbecks Arch Surg. 2008 Jul;393(4):535-45.
8. Zhao Z, Liu W. Pancreatic Cancer: A Review of Risk Factors, Diagnosis, and Treatment. Technol Cancer Res Treat. 2020 Jan-Dec;19:1533033820962117.
9. Lynch SM, Vrieling A, Lubin JH, et al. Cigarette smoking and pancreatic cancer: a pooled analysis from the pancreatic cancer cohort consortium. Am J Epidemiol. 2009 Aug 15;170(4):403-13.
10. Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013;369(18):1691–1703.
11. Conroy T, Hammel P, Hebbar M, et al. FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med. 2018; 379(25):2395–2406.
12. Kindler HL, Hammel P, Reni M, et al. Overall Survival Results From the POLO Trial: A Phase III Study of Active Maintenance Olaparib Versus Placebo for Germline BRCA-Mutated Metastatic Pancreatic Cancer. J Clin Oncol. 2022 Dec 1;40(34):3929-3939.
13. Golan T, Hammel P, Reni M, et al. Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med. 2019 Jul 25;381(4):317-327.
14. Middha S, Zhang L, Nafa K, et al. Reliable Pan-Cancer Microsatellite Instability Assessment by Using Targeted Next-Generation Sequencing Data. JCO Precis Oncol. 2017;2017:PO.17.00084.
15. Subbiah V, Wolf J, Konda B, et al. Tumour-agnostic efficacy and safety of selpercatinib in patients with RET fusion-positive solid tumours other than lung or thyroid tumours (LIBRETTO-001): a phase 1/2, open-label, basket trial. Lancet Oncol. 2022 Oct;23(10):1261-1273.
16. Schram AM, Odintsov I, Espinosa-Cotton M, et al. Zenocutuzumab, a HER2xHER3 Bispecific Antibody, Is Effective Therapy for Tumors Driven by NRG1 Gene Rearrangements. Cancer Discov. 2022 May 2;12(5):1233-1247.
17. Shaya J., Kato S., Adashek J.J., et al. Personalized matched targeted therapy in advanced pancreatic cancer: A pilot cohort analysis. NPJ Genom. Med. 2023;8:1.





