微卫星高度不稳定(MSI-H)型胃癌(GC)是一种独特的胃癌亚型,其治疗策略备受关注。尽管一线免疫检查点抑制剂联合化疗方案可能对晚期MSI-H胃癌患者有效,但在后续治疗中,尤其是在免疫治疗失败后,最佳方案仍不明确。卡度尼利单抗,作为一种创新的PD-1和CTLA-4双特异性抗体,已在一线晚期胃癌治疗中展现出积极的疗效与安全性。然而,它在经历多线治疗失败的MSI-H胃癌患者中的应用价值尚待探索。本篇将分享一例晚期MSI-H胃腺癌患者的诊疗历程,该患者在接受多种治疗方案后出现疾病进展,最终通过卡度尼利单抗联合阿帕替尼(一种抗血管生成药物)的治疗方案获得了显著且持久的缓解。通过深入分析当前MSI-H胃癌的治疗格局,本研究旨在探讨PD-1/CTLA-4双靶点免疫疗法联合抗血管生成药物作为此类胃癌挽救性治疗的潜力,为未来的临床实践和研究提供新的视角。
MSI-H胃癌治疗背景
胃癌是全球常见的消化道恶性肿瘤之一。MSI-H亚型因其对免疫治疗的特殊敏感性而备受瞩目。根据重要的临床研究(如KEYNOTE-062),对于晚期MSI-H胃癌,一线治疗推荐包括单用免疫疗法或免疫联合化疗。若患者先前未接受过免疫治疗,PD-1/PD-L1抑制剂是二线治疗的标准选择。然而,如果一线治疗已包含免疫检查点抑制剂,后续治疗方案则需依据HER2表达状态,可能选择抗血管生成药物联合抗体药物偶联物(ADCs)或其他免疫检查点抑制剂。由于MSI-H胃癌相对少见,高质量的大规模临床数据有限,特别是在HER2阴性且对PD-1/PD-L1抑制剂产生耐药的MSI-H胃癌患者中,后线治疗策略尚缺乏明确指南。
卡度尼利单抗与阿帕替尼的联合潜力
卡度尼利单抗通过同时阻断PD-1和CTLA-4这两个关键的免疫抑制通路,理论上能更有效地激活抗肿瘤免疫反应。其在一线晚期胃癌治疗中的疗效已初步得到证实(GEJCIb研究),并且有临床试验正在探索其在MSI-H肿瘤二线治疗中的应用(NCT04556253)。另一方面,阿帕替尼作为一种在中国获批用于晚期胃腺癌三线及以上治疗的抗血管生成药物,不仅能抑制肿瘤血管生成,还能改善肿瘤微环境,增加免疫细胞(如T细胞)的浸润,从而可能增强免疫治疗的效果。理论上,阿帕替尼与卡度尼利单抗联用,可以协同增效:阿帕替尼改善肿瘤微环境,使更多T细胞进入肿瘤;卡度尼利单抗则增强这些T细胞的杀伤能力。尽管前景看好,但这一联合方案在晚期MSI-H肿瘤中的确切疗效仍需更多临床数据验证。对于寻求卡度尼利单抗或阿帕替尼等前沿治疗方案的患者,了解[药物获取途径](https://medfind.link/shop)和治疗选择非常重要。
本研究报道的案例,正是一位对PD-1单抗治疗产生耐药的晚期MSI-H胃癌患者,在接受卡度尼利单抗联合阿帕替尼治疗后,实现了部分缓解(PR),并且无进展生存期(PFS)超过了20个月,这为该联合方案的应用提供了积极的信号。
病例回顾:多线治疗后的挑战与转机
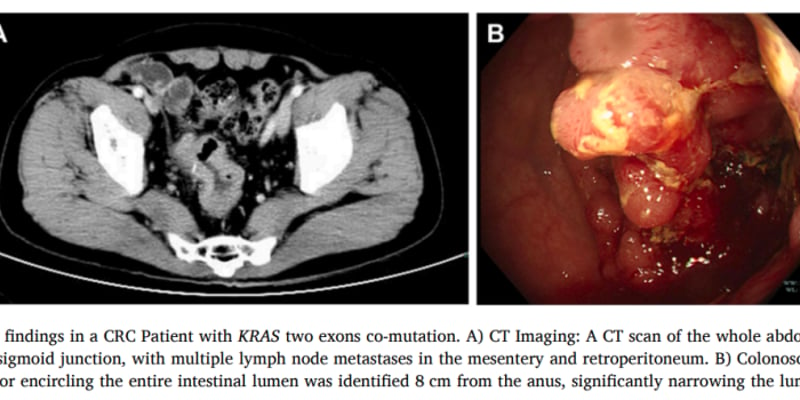
患者为59岁男性,有吸烟饮酒史,因上腹痛和黑便就诊。胃镜病理确诊为胃窦中分化腺癌。影像学检查显示存在广泛转移(腹部淋巴结、肺、肝、肾上腺)(图1A、B)。由于无法手术,患者首先接受了2个周期的SOX方案化疗。基因检测(NGS)显示:ERBB2、KRAS、PIK3CA等基因突变,肿瘤突变负荷(TMB)高(62.1 muts/Mb),微卫星高度不稳定(MSI-H),PD-L1表达阳性(TPS 10%, CPS 11)。基于ERBB2突变(注意:后续讨论指出这可能是突变而非扩增),化疗中加入了曲妥珠单抗(赫赛汀)。
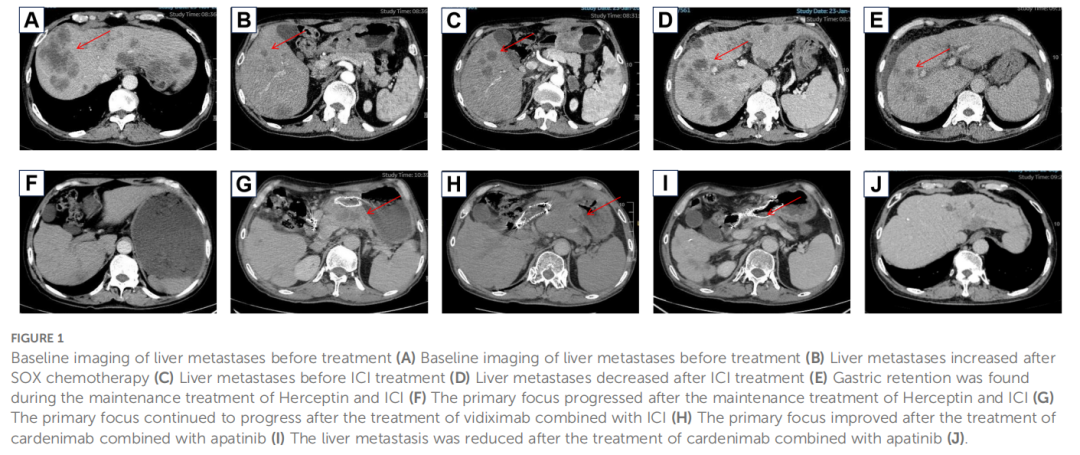
▲图1 影像学结果展示治疗过程中的病灶变化
然而,一线治疗2周期后,影像显示疾病进展(图1C)。调整为二线方案:白蛋白紫杉醇联合卡培他滨化疗,继续使用曲妥珠单抗,并基于MSI-H状态加入了纳武利尤单抗(PD-1抑制剂)(图1D)。此方案下,患者获得部分缓解(PR),症状改善,但出现副作用。随后进入曲妥珠单抗联合纳武利尤单抗维持治疗(图1E)。7个月后,出现胃潴留,行支架置入术缓解症状(图1F),继续维持治疗。
又过了5个月,复查发现多处病灶进展(图1G),提示对赫赛汀和纳武利尤单抗可能产生耐药。启动三线治疗:抗HER2 ADC药物维迪西妥单抗联合纳武利尤单抗。但3个月后,胃部原发灶仍持续进展(图1H)。
鉴于多线治疗失败,特别是对PD-1抑制剂纳武利尤单抗的耐药,患者进入四线治疗。首先尝试卡度尼利单抗单药治疗,3个月后评估为疾病稳定(SD),但病灶有轻微增大。随后,在卡度尼利单抗基础上加用阿帕替尼。联合治疗6个月后,影像学显示原发灶和肝转移灶显著改善,达到部分缓解(PR)(图1I、J)。治疗期间,患者出现肝脓肿(图2A),经穿刺引流和抗生素治疗后好转(图2B)。截至报告时,联合治疗已持续20个月,患者症状明显改善,多处转移灶缩小甚至消失,仍在随访中。患者的肿瘤标志物变化和治疗时间线总结见图表(表1,图3)。
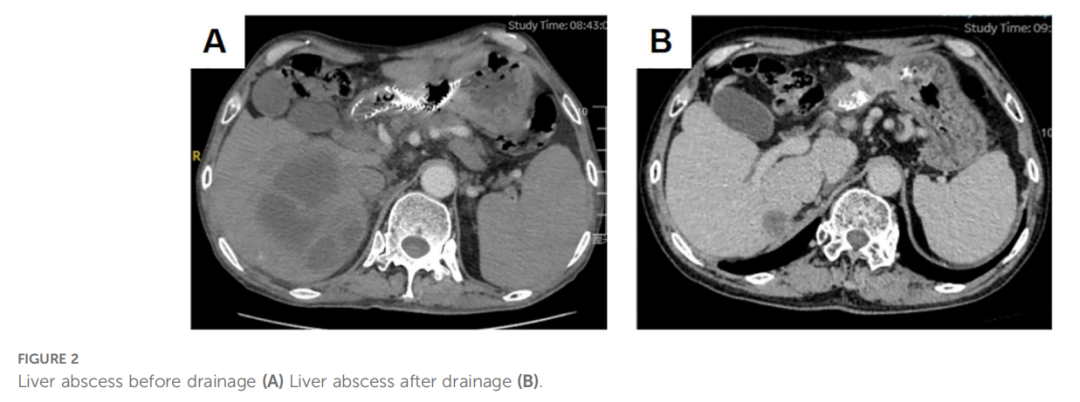
▲图2 肝脓肿引流前(A)与引流后(B)对比
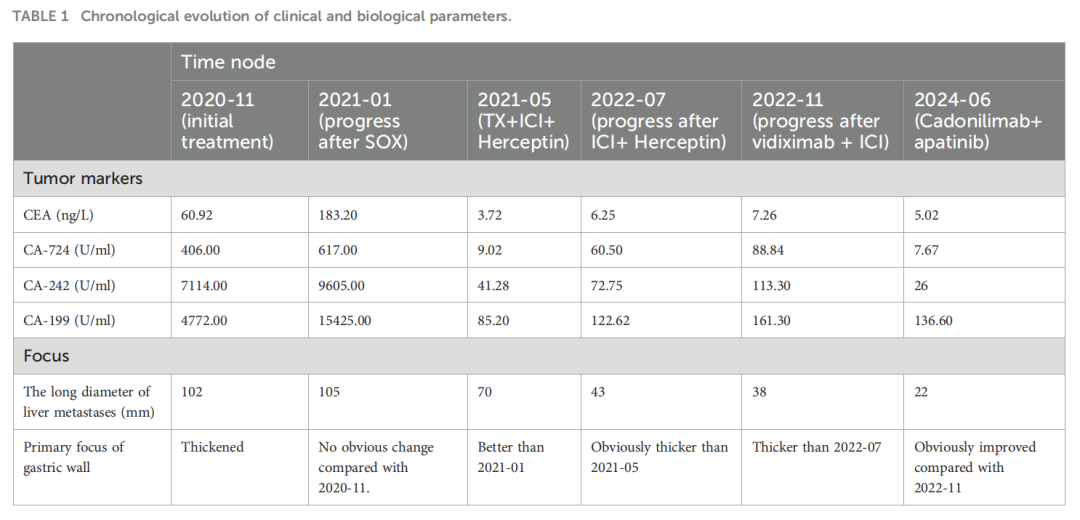
▲表1 临床和生物学参数的时间演变
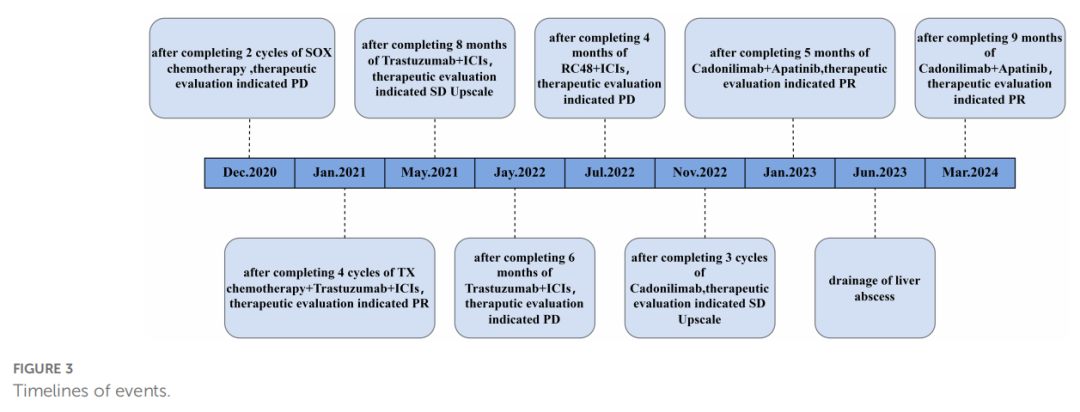
▲图3 事件时间线
深度讨论:治疗策略与启示
MSI-H胃癌的化疗挑战: 本案例中,一线化疗效果不佳,可能与MSI-H肿瘤对某些化疗药(如5-FU类)的天然耐药性有关。虽然化疗仍是胃癌治疗的基础,但在MSI-H亚型中,其与免疫治疗的联合应用效果及长期获益仍需更多研究探索。
基因突变与靶向治疗的思考: 患者检测出ERBB2(HER2)基因突变,而非典型的基因扩增或蛋白高表达。这可能解释了为何后续使用的抗HER2靶向药(曲妥珠单抗)和ADC药物(维迪西妥单抗)疗效有限。研究表明,ERBB2扩增与MSI-H在胃癌中往往互斥,但ERBB2突变在MSI-H中可能存在。未来,针对HER2突变的药物(如T-DXd)或许是值得探索的方向。此外,患者还携带KRAS和PIK3CA突变,虽然KRAS突变通常预后不佳,但在MSI-H背景下可能影响不同。针对这些通路的靶向药物也可能成为未来治疗的备选。对于复杂的基因突变信息解读和治疗选择,患者或可考虑使用[AI智能问诊](https://medfind.link/ai)等工具获取初步的个性化信息参考。
PD-1/CTLA-4双特异性抗体的价值: 卡度尼利单抗通过同时阻断PD-1和CTLA-4通路,旨在产生比单靶点抑制剂更强的抗肿瘤免疫。本例患者在PD-1单抗耐药后,使用卡度尼利单抗联合阿帕替尼取得了显著疗效,提示双靶点免疫联合策略可能克服部分免疫耐药。虽然卡度尼利单抗单用时病灶略有增大,但加用阿帕替尼后效果显著,凸显了联合治疗的重要性。目前有临床试验(NCT04547101)正在评估卡度尼利单抗在MSI-H/dMMR晚期实体瘤后线治疗的效果,值得期待。
抗血管生成的协同作用: 阿帕替尼等抗血管生成药物通过抑制肿瘤血管生成(靶向VEGFR通路),不仅直接抑制肿瘤生长,还能改善肿瘤微环境,使其更利于免疫细胞浸润和发挥作用。本案例中阿帕替尼的加入显著提升了卡度尼利单抗的疗效,支持了抗血管联合免疫治疗的策略。多项临床试验正在探索这类联合方案在晚期胃癌中的应用(表2)。获取更多关于[胃癌治疗方案](https://medfind.link/info)和[靶向药物信息](https://medfind.link/info),有助于患者和家属了解最新的治疗选择。
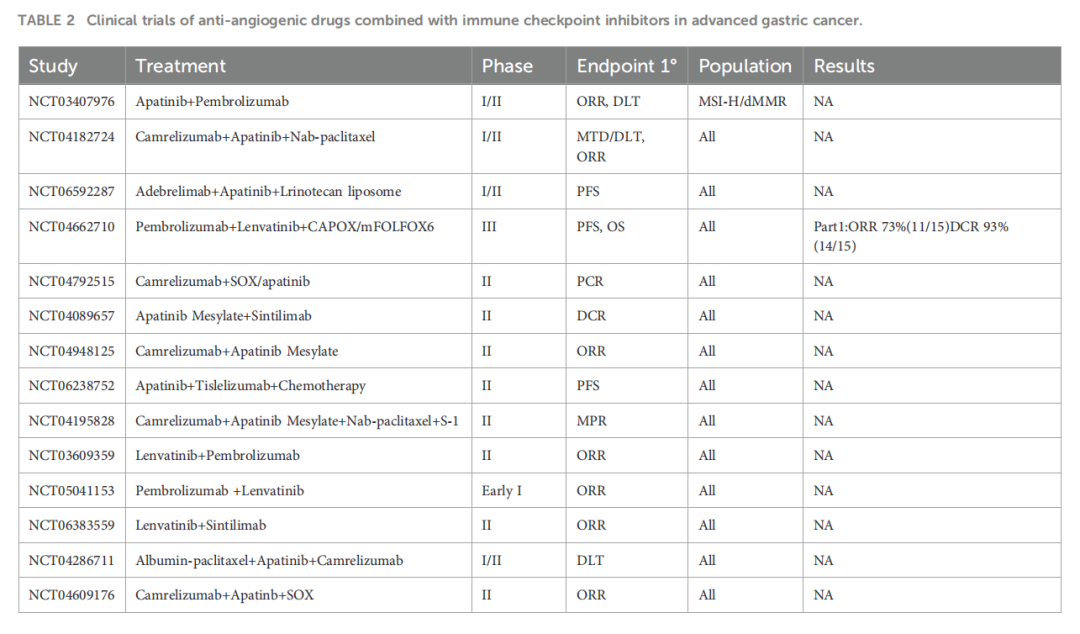
▲表2 抗血管生成药物联合免疫检查点抑制剂在晚期胃癌治疗中的临床试验
MSI-H胃癌挽救治疗的探索: 对于MSI-H胃癌,尤其是在免疫治疗失败后,标准的挽救治疗方案仍不明确。既往研究显示,帕博利珠单抗、纳武利尤单抗单药或联合伊匹木单抗在后线治疗中有一定疗效,但联合治疗毒性增加。TAS-102和阿帕替尼也在三线及以上治疗中显示出生存获益。本案例提出的卡度尼利单抗联合阿帕替尼方案,为这一治疗困境提供了新的可能方向。
研究局限性: 本研究为单病例报告,结果的外推性有限。患者未进行HER2蛋白表达的免疫组化确认。此外,患者使用的卡度尼利单抗剂量(q3w)与标准剂量(q2w)存在差异,可能影响结果解读。
结论与展望
免疫检查点抑制剂(ICIs)无疑改变了MSI-H胃癌的治疗格局,但获得性耐药仍然是一个严峻挑战。本病例成功展示了卡度尼利单抗(PD-1/CTLA-4双特异性抗体)联合阿帕替尼(抗血管生成药物)作为一种有效的挽救治疗策略,能够克服先前对PD-1单抗的耐药,为患者带来长期生存获益。这一结果强烈提示,对于ICI治疗失败的晚期MSI-H胃癌患者,双重免疫检查点阻断联合抗血管生成治疗可能是一种极具潜力的治疗选择。未来需要更大规模的临床研究来进一步验证该联合方案的疗效和安全性,并探索其在MSI-H肿瘤治疗中的最佳应用时机。对于需要了解卡度尼利单抗、阿帕替尼或其他[海外抗癌新药](https://medfind.link/shop)信息的患者,可以通过可靠渠道获取帮助。
参考文献:
Zhao J, Li X, Sun X, Xiao R, Xue J, Sui K and Liu Z (2025) Combination of cadonilimab (PD-1/CTLA-4 bispecific antibody) and apatinib as salvage therapy achieves partial response in MSI-H advanced gastric cancer: a case report. Front. Immunol. 16:1533700. doi: 10.3389/fimmu.2025.1533700