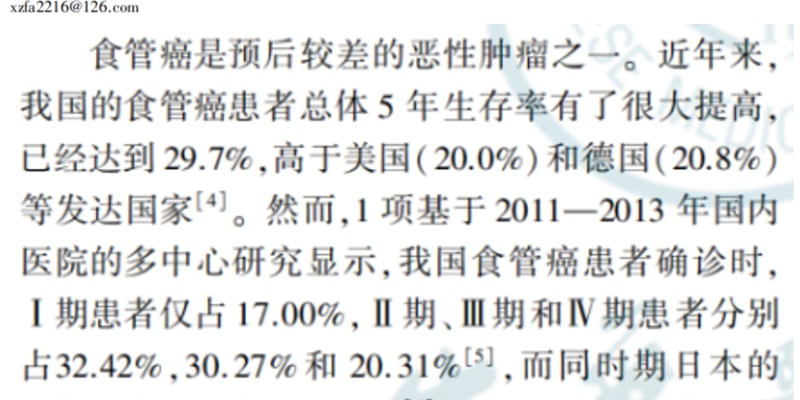
近年来,靶向蛋白降解(Targeted Protein Degradation, TPD)技术为小分子药物的研发带来了革命性的变化。其中,以PROTACs(蛋白质水解靶向嵌合体)和分子胶为代表的细胞内TPD(iTPD)策略备受瞩目。这些技术通过利用细胞自身的泛素-蛋白酶体系统来降解致病蛋白,开辟了**癌症治疗**的新途径。
然而,iTPD主要针对细胞内的蛋白质。为了克服这一局限,科学界将目光投向了细胞外的广阔空间,催生了细胞外靶向蛋白降解(eTPD)这一新兴领域。eTPD旨在清除细胞膜表面或分泌到细胞外的致病蛋白质,为**靶向药**和**抗癌药**的开发提供了全新的思路。
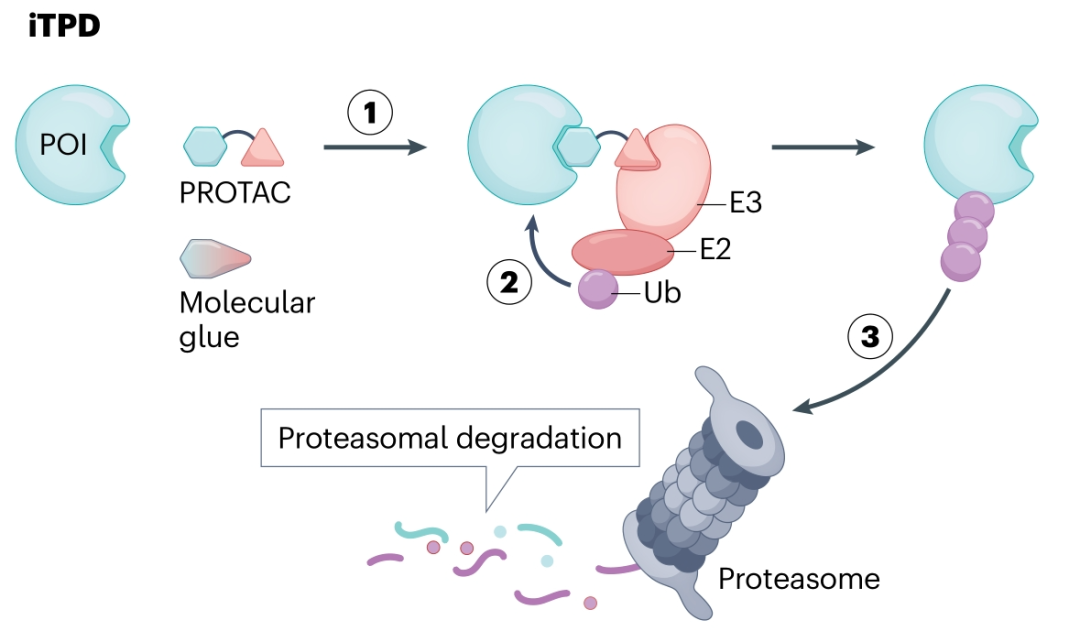
eTPD与iTPD的核心区别
尽管目标都是降解蛋白质,eTPD与iTPD在机制上存在显著差异:
- 降解途径不同: iTPD主要依赖细胞内的蛋白酶体系统;而eTPD则利用细胞的内吞作用,将目标蛋白(POI)通过特定的膜结合受体转运至溶酶体进行降解,这是处理细胞外蛋白的主要途径。
- 作用分子不同: iTPD通常使用小分子(PROTACs, 分子胶);eTPD则常涉及双特异性的大分子(如抗体)或特殊设计的小分子,一端结合目标蛋白,另一端结合负责内吞转运的细胞表面受体。
- 降解动力学不同: iTPD通常较快(分钟至小时级别);eTPD涉及跨膜运输和细胞器融合,速度相对较慢(通常6-48小时)。
- 降解系统选择性: iTPD目前主要依赖少数几种E3连接酶(如CRBN, VHL),限制了组织特异性;eTPD可利用的内吞受体种类更多样,为实现组织选择性降解提供了更大潜力。
eTPD相较于传统生物药的潜在优势
当前生物药领域已有多种成熟模式,如单克隆抗体、抗体偶联药物(ADC)、双特异性抗体和CAR-T细胞疗法等。eTPD并非要取代这些疗法,而是在特定场景下提供独特的优势:
- 催化降解 vs 化学计量阻断: 传统抗体通过结合来阻断功能,需要足量的抗体分子;eTPD分子理论上可以像催化剂一样,反复介导多个目标蛋白的降解,可能实现更低的给药剂量和频率,这对于目标蛋白表达量高的疾病尤其有意义。
- 彻底清除 vs 功能阻断: eTPD旨在完全清除整个蛋白质,包括其可能存在的支架功能或其他未知功能,效果更彻底,类似于基因敲除。
- 克服耐药性: 传统抑制剂可能因靶点突变而失效,而eTPD降解不依赖于特定的活性位点,可能对突变靶点依然有效。
- 避免靶蛋白积累: 某些治疗性抗体(如贝伐珠单抗之于VEGF)可能延长靶蛋白的半衰期,产生非预期的“缓冲效应”。eTPD通过直接降解,可避免此类问题。
这些优势使得eTPD在**新药研发**领域,特别是在开发新型**抗癌药**和治疗慢性疾病药物方面,展现出巨大的潜力。
探索多样的eTPD实现策略
目前,研究人员正在探索多种利用细胞内吞和溶酶体途径实现eTPD的方法:
1. 基于FcRn的清除抗体策略
通过改造抗体的Fc段,使其在特定pH条件下与新生儿Fc受体(FcRn)结合,同时又能结合可溶性目标蛋白(如IL-6R)。这种改造后的抗体(如pH可切换的托珠单抗 Tocilizumab)能将目标蛋白“捕获”并递送至酸性内体,目标蛋白在此被释放并进入溶酶体降解,而抗体则通过FcRn回收再利用。这种策略已诞生了首个获批的eTPD药物(用于视神经脊髓炎谱系障碍)。对于需要长期使用如托珠单抗这类药物的患者,了解其海外代购渠道和价格信息可能十分重要。

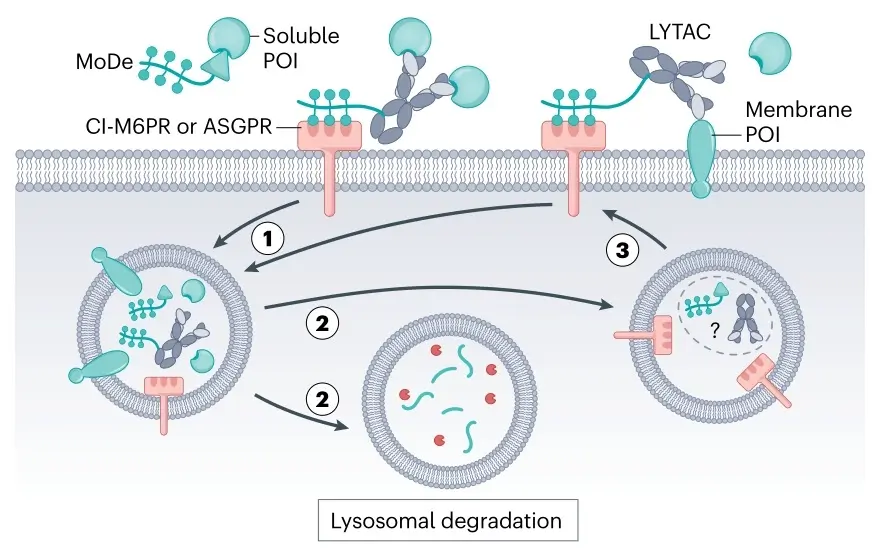
2. 基于聚糖受体的eTPD(LYTACs, ATACs/MoDEs)
利用细胞表面表达的聚糖识别受体,如阳离子非依赖性甘露糖6-磷酸受体(CI-M6PR)或去唾液酸糖蛋白受体(ASGPR)。通过将识别这些受体的聚糖配体(如M6P或GalNAc)与靶向POI的抗体或小分子偶联,形成嵌合体(LYTACs或ATACs/MoDEs)。这些嵌合体能桥接目标蛋白和内吞受体,介导复合物内化并最终在溶酶体中降解POI。ASGPR主要在肝脏高表达,为肝脏靶向的药物递送提供了可能。例如,已有研究利用此策略降解EGFR等膜蛋白。
3. 基于跨膜E3连接酶的eTPD(AbTACs, PROTABs, REULRs)
细胞内存在大量E3连接酶,细胞膜上也存在一类含有跨膜结构域的E3连接酶(如RNF43, ZNRF3)。通过设计双特异性抗体(AbTACs, PROTABs)或分子(REULRs),一端结合目标膜蛋白(如PD-L1, EGFR, HER2),另一端结合跨膜E3连接酶的胞外域。这种结合能将目标蛋白“标记”并引导至降解途径。这种策略主要针对膜蛋白。

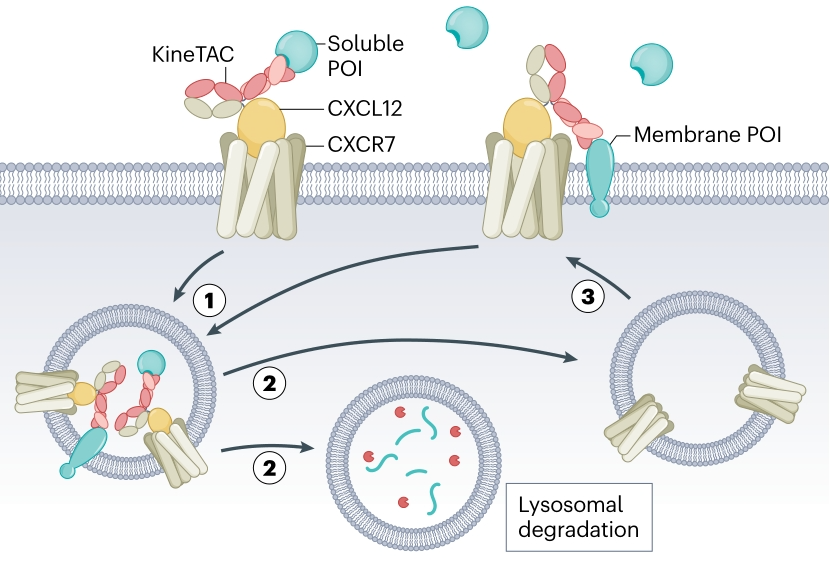
4. 基于细胞因子受体的eTPD(KineTACs)
许多细胞因子受体在结合配体后会发生内化并进入溶酶体降解。KineTAC策略利用了这一生理过程。例如,构建一种嵌合分子,一端是能结合目标蛋白(如PD-L1, HER2)的抗体片段(如阿替利珠单抗 Atezolizumab或曲妥珠单抗 Trastuzumab的Fab段),另一端是能够被特定细胞因子受体(如CXCR7)识别并内化的配体(如CXCL12)。这样,KineTAC分子就能“劫持”细胞因子受体的内吞途径来降解目标蛋白。
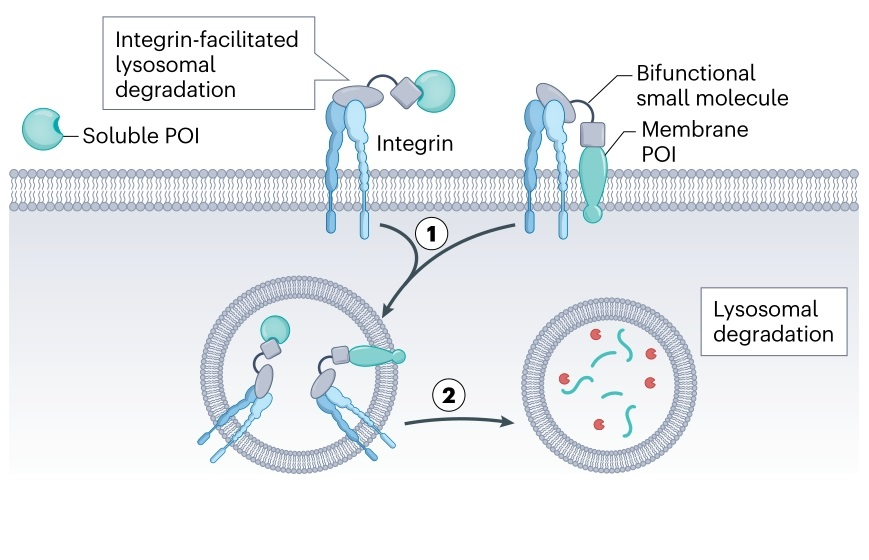
5. 基于整合素的eTPD
整合素(如αVβ3)是介导细胞粘附的重要分子,在肿瘤细胞中常常高表达,并且能够内化结合特定配体(如含RGD基序的分子)。研究人员利用这一点,设计了含有RGD基序并能结合目标蛋白(如通过连接小分子抑制剂BMS-8靶向PD-L1)的嵌合分子。这种分子能利用整合素的内吞途径将目标蛋白转运至溶酶体降解,有望实现肿瘤选择性的蛋白降解。
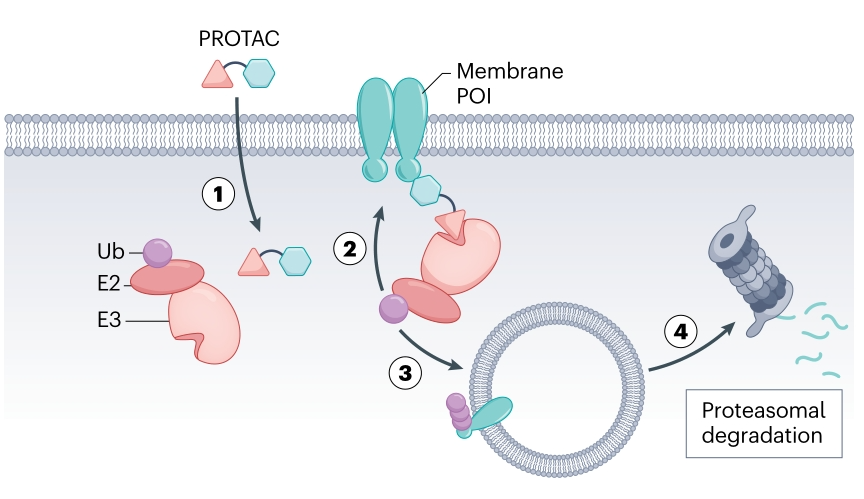
靶向膜蛋白的胞内降解策略补充
值得注意的是,除了上述eTPD策略,针对膜蛋白(如受体酪氨酸激酶RTK,包括EGFR, MET等),也可以利用经典的iTPD思路,即设计能够穿透细胞膜的PROTAC分子,一端结合RTK的胞内结构域,另一端招募胞内的E3连接酶(如VHL或CRBN),通过蛋白酶体途径从“内部”降解这些膜蛋白。例如,C4 Therapeutics开发的EGFR降解剂CFT8919即属此类。与单纯抑制相比,降解RTK可能更有效,并能克服某些耐药机制。
结语与展望
细胞外靶向蛋白降解(eTPD)作为一个新兴的药物研发领域,充满了机遇和挑战。哪种eTPD策略最为有效?哪些靶点和疾病领域最适合eTPD?如何实现精准的组织选择性并确保安全性?潜在的耐药机制是什么?这些都是未来研究需要回答的关键问题。
尽管如此,eTPD技术的多样化发展无疑为**靶向药**和**抗癌药**的未来注入了新的活力。随着研究的深入,我们有理由期待eTPD能够带来更多创新的治疗选择。对于关注前沿**癌症治疗**进展的患者和家属而言,了解这些新兴技术至关重要。如果您对具体的靶向药物信息、治疗方案或**海外购药**途径(如靶向药和仿制药代购)有疑问,可以查阅相关抗癌资讯或利用AI问诊服务获取初步信息。