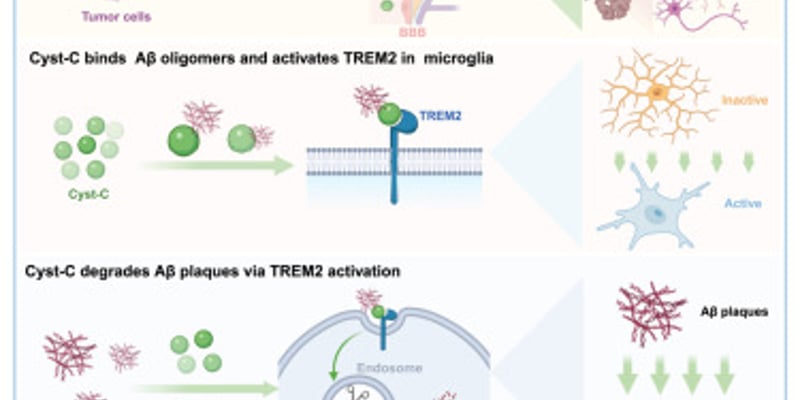
摘要
美国Aulos Bioscience公司公布了新药AU-007的初期临床试验数据结果,该药在黑色素瘤、肾细胞癌等多种局部晚期或转移性实体瘤中展现出令人鼓舞的疗效,并且安全性良好。
关键信息如下:
在近期举行的第38届癌症免疫治疗学会(SITC)年会上,美国免疫肿瘤学公司Aulos Bioscience公布了新药AU-007的临床试验新进展。
-
在1期剂量递增队列中,33名可评估患者中,有9名患者(27%)反应良好,疾病实现稳定。截至数据截止日期,16名患者仍在继续接受治疗。 -
1名黑色素瘤患者在接受抗CTLA-4和抗PD-1治疗无效的情况下,接受AU-007治疗后,经过CT扫描,肿瘤病灶缩小了40%,并且从治疗第8周开始便观察到肿瘤缩小,第16周和24周时肿瘤进一步缩小。目前这名患者仍在继续参与研究。 -
1名肾细胞癌患者在先前接受抗PD-1治疗后疾病持续进展的情况下,接受AU-007治疗后,经过CT扫描,从第8周开始肿瘤病灶缩小了20%。目前这名患者也在继续参与研究。