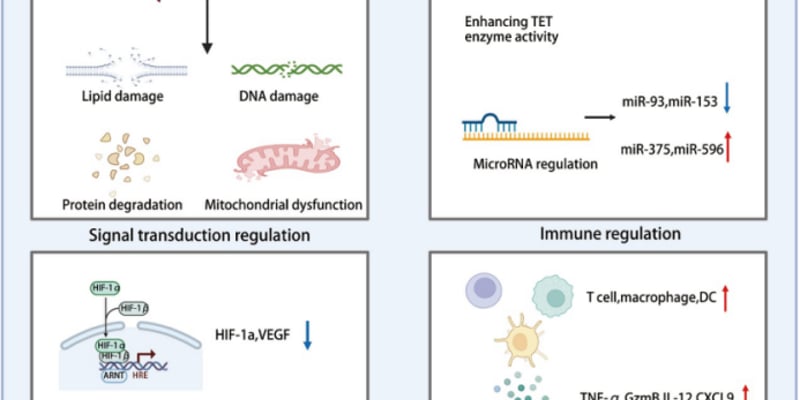
摘要
近日,美国纪念斯隆凯特琳癌症中心公布了一项新研究结果:由荷兰生物制药公司Merus研发的新型“双抗”治疗药物Zenocutuzumab,在NRG1阳性晚期非小细胞肺癌患者中取得了很好的疗效并且副作用可控。
关键信息如下:
近日,美国纪念斯隆凯特琳癌症中心公布了1/2期eNRGy试验的结果:在携带NRG1基因融合的晚期非小细胞肺癌患者中,新药Zenocutuzumab(MCLA-128)的治疗效果很好,并且副作用可控。
具体来说,在可评估疗效的78名NRG1阳性患者中,Zenocutuzumab使得37.2%的患者肿瘤大幅缩小,另外还有30名患者病情稳定,没有进一步加重。