嵌合抗原受体T细胞(CAR T)疗法自问世以来,彻底改变了血液恶性肿瘤(如白血病和淋巴瘤)的治疗格局。然而,将这种革命性的疗法成功应用于实体瘤,如肺癌、乳腺癌或胰腺癌,一直面临巨大的挑战。近期,罗斯威尔公园综合癌症中心(Roswell Park Comprehensive Cancer Center)的研究团队在《Cancer Cell》上发表了一项具有里程碑意义的临床前研究,首次证明利用细胞因子IL-36γ“武装”的CAR T细胞,能够有效重编程患者自身的免疫细胞,从而实现实体瘤的根除。这项研究为小细胞肺癌(SCLC)等难治性实体瘤的治疗带来了新的希望,也为癌症患者寻求AI辅助问诊服务和前沿治疗方案提供了重要的参考信息。
实体瘤治疗的困境:传统CAR T细胞疗法面临的挑战
CAR T细胞疗法的工作原理是收集患者自身的T细胞,通过基因工程使其表达一个嵌合抗原受体(CAR),该受体能够识别并精准锁定癌细胞表面的特定抗原。这些经过重新设计的T细胞在体外扩增后回输到患者体内,发起强大的免疫攻击。
尽管CAR T细胞在血液肿瘤中取得了惊人的高缓解率,但在实体瘤领域,其疗效却大打折扣,主要原因在于以下几个关键障碍:
1. 肿瘤微环境(TME)的抑制作用
实体瘤周围存在一个复杂的保护性网络,即肿瘤微环境(TME)。TME富含抑制性细胞、纤维组织和异常血管,会释放大量的免疫抑制分子,使CAR T细胞难以浸润肿瘤内部,即使进入,也会被“耗竭”或抑制其活性,无法有效发挥杀伤作用。
2. 肿瘤抗原的异质性与逃逸
实体瘤细胞表面往往存在多种抗原,且肿瘤细胞具有高度的异质性。传统的CAR T细胞通常只靶向一到两种抗原。如果癌细胞停止表达这些靶向抗原(即抗原逃逸),它们就能“躲藏”起来,使CAR T细胞失去目标,导致治疗失败或复发。
3. T细胞的浸润与持久性不足
与血液肿瘤不同,CAR T细胞难以大量、均匀地渗透到实体瘤的深处。即使成功浸润,它们在TME中的持久性也较差,很快就会功能衰竭。
IL-36γ武装的CAR T细胞:激活内源性免疫的新策略
由Renier Brentjens博士领导的罗斯威尔公园研究团队,旨在开发一种能够克服TME抑制,并利用患者自身免疫系统力量的新一代CAR T细胞。他们的核心创新在于使用细胞因子IL-36γ(白细胞介素36γ)来“武装”CAR T细胞。
IL-36γ的作用机制:重编程中性粒细胞
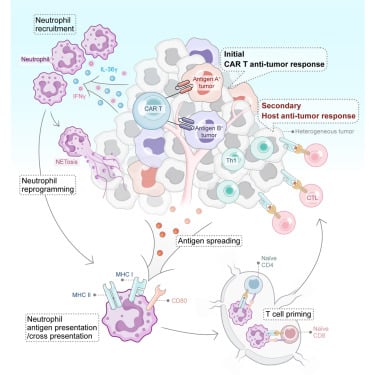
IL-36γ是一种对免疫细胞具有广泛影响的蛋白质,尤其与炎症和免疫反应的激活密切相关。研究团队发现,当CAR T细胞被IL-36γ武装后,它们不再仅仅依靠自身的杀伤力,而是能够充当“指挥官”,重编程TME中的关键免疫细胞——中性粒细胞。
中性粒细胞是白细胞中最常见的一种,传统上被认为主要参与抵抗细菌感染。然而,在癌症背景下,中性粒细胞的作用非常复杂,它们有时会促进肿瘤生长,有时又具有抗肿瘤活性。这项研究的关键突破在于:
- 激活免疫协作: IL-36γ武装的CAR T细胞能够诱导中性粒细胞获得强大的抗原呈递功能。这意味着中性粒细胞不再是肿瘤的旁观者或帮凶,而是被转化为能够识别和展示肿瘤抗原的免疫细胞。
- 驱动适应性免疫: 被重编程的中性粒细胞随后能够激活患者自身的适应性抗肿瘤免疫反应,包括其他T细胞和免疫细胞。这种“免疫协作”机制,使得抗肿瘤反应不再局限于最初设计的CAR T细胞靶点,从而有效应对肿瘤抗原的异质性和逃逸问题。
正如研究第一作者Yihan Zuo博士所说,这项研究揭示了“意想不到水平的免疫协作”,为开发针对实体瘤的下一代细胞疗法开辟了新的可能性。
突破传统限制:无需淋巴细胞清除的优势
标准CAR T细胞疗法通常需要进行治疗前的淋巴细胞清除(Lymphodepletion)。这是一个关键步骤,通过化疗清除患者体内的淋巴细胞,为回输的CAR T细胞腾出空间,并减少内源性免疫细胞对CAR T细胞的竞争和抑制。
然而,淋巴细胞清除步骤本身会带来副作用和风险。IL-36γ武装的CAR T细胞平台提供了一个重大的临床优势:
- 保留中性粒细胞: 这种独特的治疗策略跳过了传统的淋巴细胞清除步骤。
- 招募内源力量: 保留中性粒细胞意味着武装的IL-36γ CAR T细胞可以立即将这些内源性免疫细胞招募到抗肿瘤反应中。中性粒细胞作为抗原呈递细胞的转化,是实现强大抗肿瘤免疫的关键,避免了化疗带来的额外负担。
这一发现不仅简化了治疗流程,也可能降低患者的治疗毒性,提升治疗的可及性。
小细胞肺癌(SCLC)模型中的疗效验证
研究团队利用小细胞肺癌(SCLC)的临床前模型评估了IL-36γ武装的CAR T细胞的有效性。小细胞肺癌是一种高度恶性、预后极差的实体瘤,对传统治疗方案的反应有限,急需新的治疗手段。
在临床前模型中,IL-36γ CAR T细胞展示了根除肿瘤的潜力。这一结果证实了该平台在晚期实体瘤癌症中的应用前景,特别是对于那些目前尚无治愈方法的患者。这一突破性进展,为肺癌患者提供了新的治疗方向,患者和家属可以关注此类前沿疗法的临床试验进展,并了解相关的抗癌药品代购与国际直邮服务,为未来的治疗选择做好准备。

实体瘤免疫治疗的未来展望
CAR T细胞疗法在实体瘤中的应用,正从第一代单纯靶向抗原,向第二代、第三代结合细胞因子或基因编辑技术,以克服TME限制的方向发展。IL-36γ武装的CAR T细胞代表了这一领域的重大飞跃,它不再仅仅依赖T细胞自身的杀伤力,而是通过调动和重编程患者自身的先天免疫系统(中性粒细胞),实现更广泛、更持久的抗肿瘤效果。
1. 克服抗原逃逸
通过中性粒细胞的抗原呈递功能,该疗法能够激活针对多种肿瘤抗原的适应性免疫反应,有效弥补了传统CAR T细胞因抗原逃逸而失效的缺陷。
2. 增强TME浸润
IL-36γ作为一种细胞因子,可能有助于改善CAR T细胞在肿瘤微环境中的浸润和活性,使其能够更有效地穿透肿瘤屏障。
3. 广泛的适用性
虽然该研究主要在小细胞肺癌模型中进行,但其机制——利用细胞因子重编程中性粒细胞——理论上可以应用于多种实体瘤类型,包括黑色素瘤、结直肠癌、乳腺癌等,只要找到合适的肿瘤特异性靶点。
这项研究的共同资深作者Scott Abrams博士指出:“这一独特的CAR T细胞/IL-36γ配对方式的发现,不仅是我们对免疫-肿瘤相互作用基本理解上的突破,也是在攻击实体癌方面的一个关键进展,这始终是一个长期存在的难题。”
对癌症患者的意义:如何关注前沿治疗选择?
对于正在与实体瘤抗争的患者及其家属而言,这项研究代表了未来治疗方案的巨大潜力。虽然IL-36γ武装的CAR T细胞目前仍处于临床前研究阶段,但其机制的突破性意味着下一代细胞疗法将更具针对性和有效性。
1. 关注临床试验进展
患者应密切关注这类前沿细胞疗法何时进入临床试验阶段。参与临床试验是获取创新治疗机会的重要途径。了解最新的临床研究和指南资讯,可以帮助患者做出更明智的治疗决策。
2. 免疫治疗的协同效应
这项研究强调了免疫系统各组成部分(T细胞、中性粒细胞、细胞因子)协同作用的重要性。未来,实体瘤的治疗将越来越依赖于联合疗法,即结合CAR T、检查点抑制剂或其他免疫调节剂,以最大化抗肿瘤效果。
3. 药物获取渠道的准备
随着创新疗法的不断涌现,许多最新的抗癌药物和细胞疗法可能首先在海外获批。对于需要获取国际前沿药物的患者,了解可靠的海外用药选择和药物获取渠道至关重要,以确保在需要时能够及时获得所需的治疗支持。
总而言之,IL-36γ武装的CAR T细胞研究为实体瘤免疫治疗打开了一扇新的大门,通过重编程中性粒细胞,激活了强大的内源性抗肿瘤免疫力。这一策略有望克服传统CAR T疗法的局限性,特别是在小细胞肺癌等难治性癌症中,为患者带来更高效、更安全的治疗选择。