免疫系统的“警报”:颠覆认知的危险理论
长久以来,免疫学领域一直被“自我-非我”识别理论所主导。该理论认为,免疫系统的核心任务是区分“自己人”(自身细胞)和“外来者”(如细菌、病毒),并精准地清除后者。然而,这一经典理论在解释许多免疫现象时显得力不从心,例如为什么我们能与体内的共生菌群和平共处?为什么免疫系统有时会攻击自身组织(自身免疫病)?以及,为什么它常常对体内的“叛徒”——癌细胞视而不见?
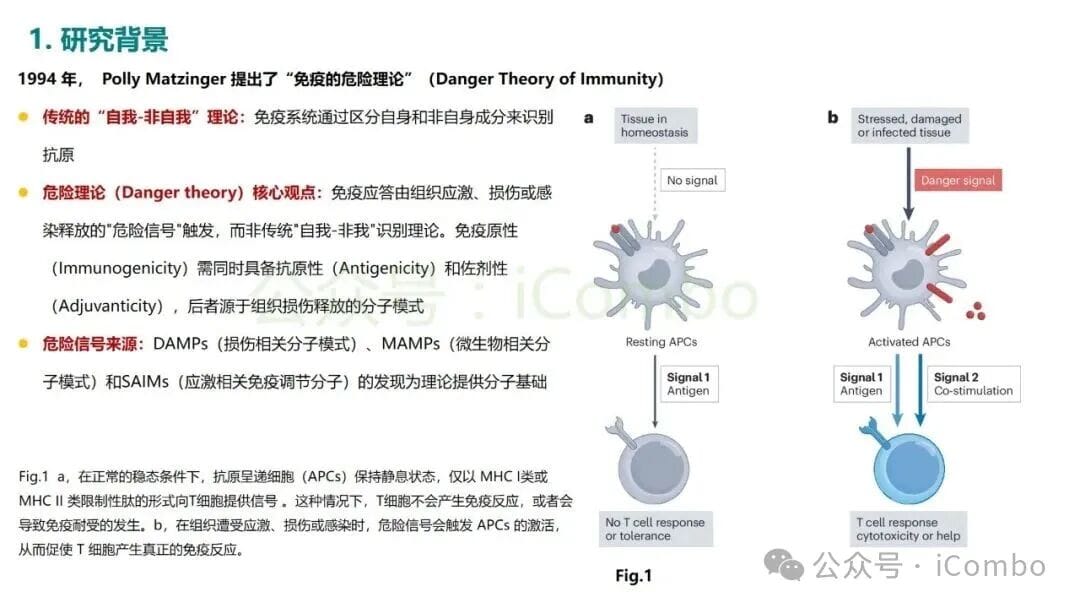
1994年,免疫学家Polly Matzinger提出了一个颠覆性的观点——“危险理论”(Danger Theory)。该理论的核心思想是,免疫系统启动攻击的根本原因,并非识别到“非我”物质,而是感知到了“危险信号”。这些信号通常由受损、应激或垂死的细胞释放,仿佛在向免疫系统大声呼救:“这里出事了,快来帮忙!”
这一理论的提出,为我们理解免疫系统的运作方式,尤其是在癌症治疗中的作用,打开了一扇全新的大门。它完美地解释了为何某些传统的癌症疗法,如化疗和放疗,在杀死癌细胞的同时,竟能意外地唤醒免疫系统,使其参与到抗癌的战斗中来。
危险信号的本质:DAMPs与免疫原性细胞死亡(ICD)
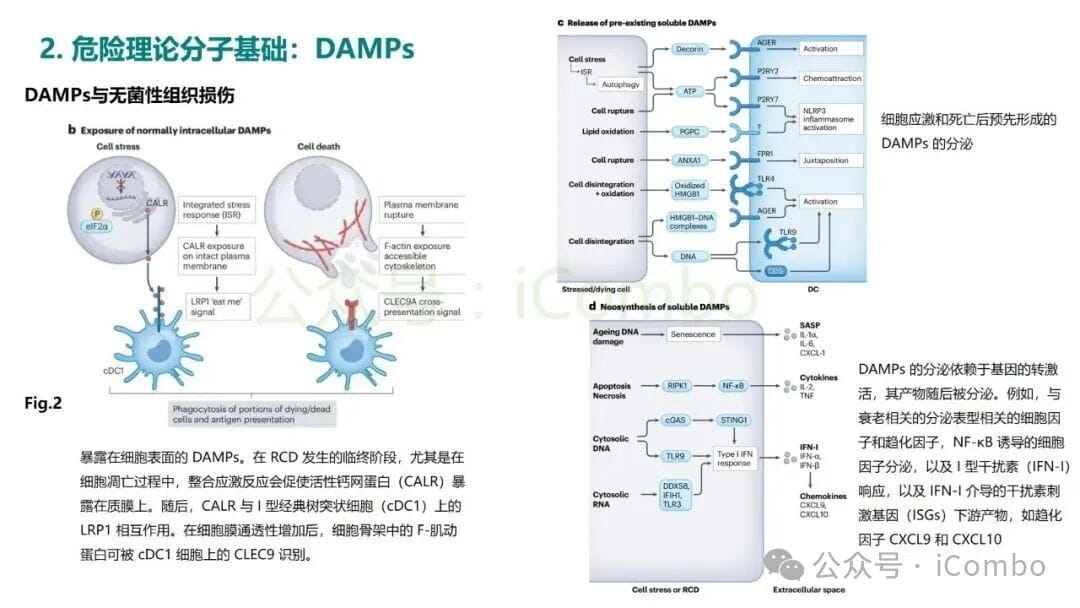
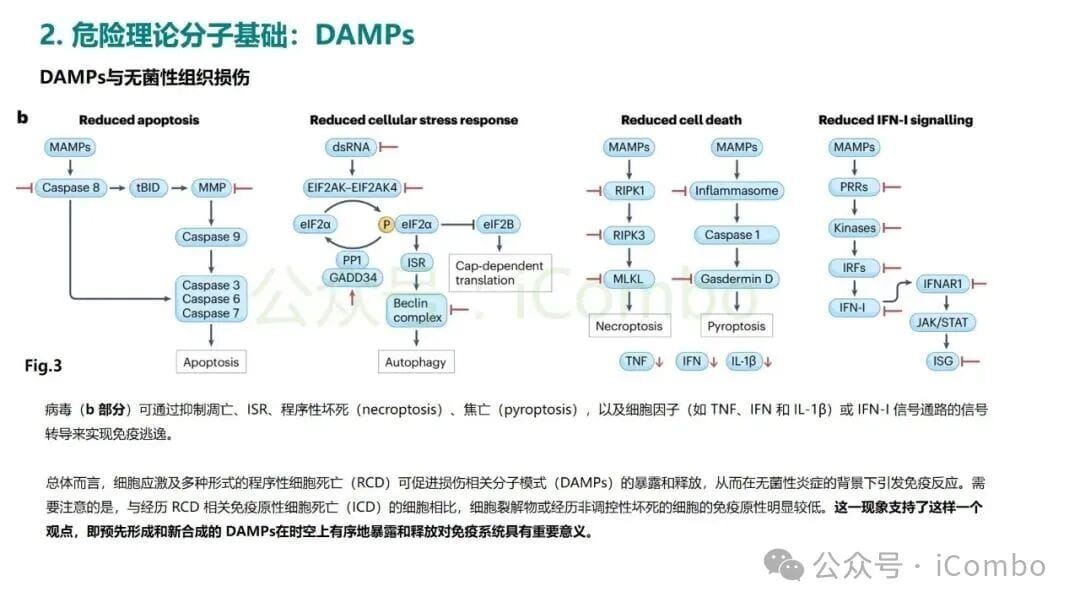
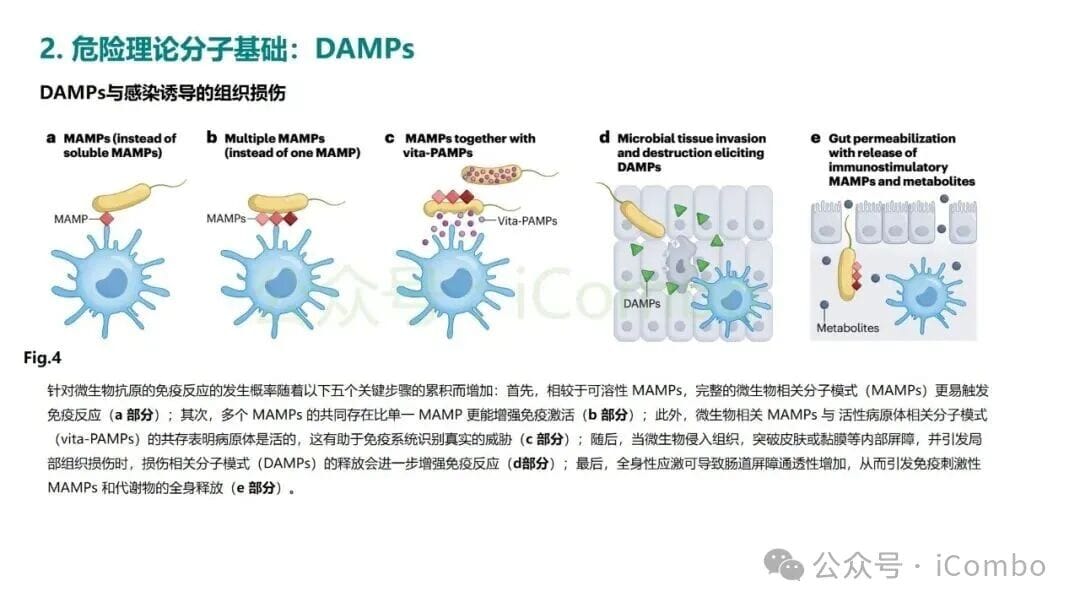
那么,究竟什么是“危险信号”呢?在危险理论的框架下,这些信号被称为损伤相关分子模式(Damage-Associated Molecular Patterns, DAMPs)。当细胞在非正常情况下(如受到化疗药物攻击、放射线损伤或病毒感染)死亡时,会向周围环境释放或在细胞表面暴露一系列本不该出现在那里的分子。这些分子就是DAMPs,它们是免疫系统的“哨兵”——树突状细胞(DC)等抗原提呈细胞(APC)的强烈激活剂。
常见的DAMPs包括:
- ATP(三磷酸腺苷): 正常情况下存在于细胞内,作为能量货币。当它大量出现在细胞外时,就成了一个强烈的“求救”信号。
- HMGB1(高迁移率族蛋白B1): 一种通常位于细胞核内的蛋白质,细胞坏死时会释放出来,激活免疫反应。
- 钙网蛋白(Calreticulin, CRT): 当细胞处于应激状态时,钙网蛋白会从内质网转移到细胞膜表面,这是一个“吃掉我”的信号,能吸引吞噬细胞前来清理,并启动后续的免疫应答。
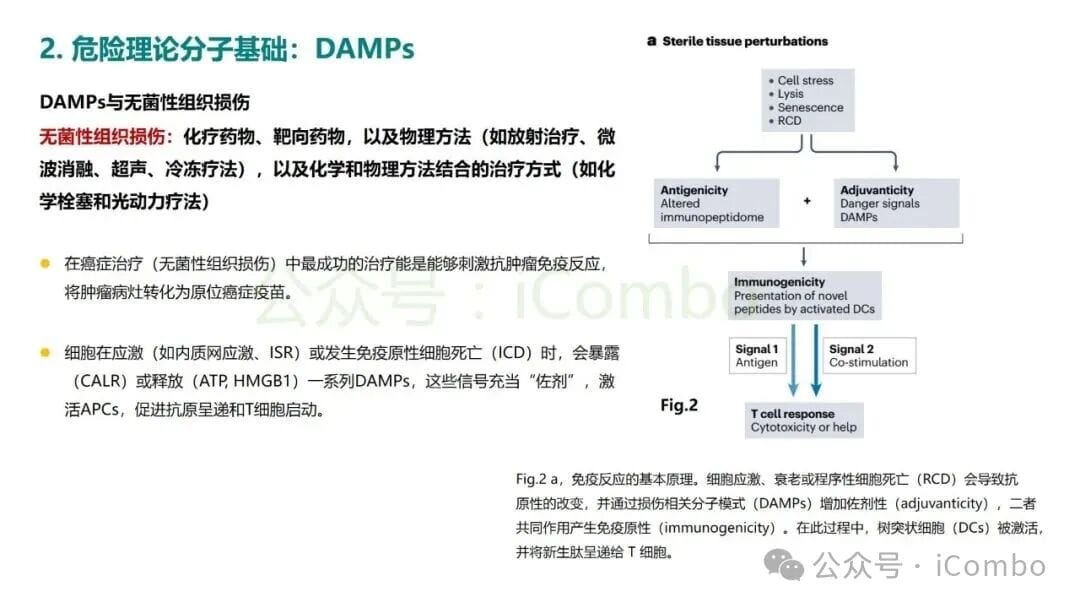
这种由DAMPs释放所引发的、能够有效激活适应性免疫反应的细胞死亡方式,被称为免疫原性细胞死亡(Immunogenic Cell Death, ICD)。ICD是危险理论在癌症治疗中最核心的应用场景。当化疗或放疗成功诱导癌细胞发生ICD时,垂死的癌细胞就不再是一具无声的“尸体”,而是一个会鸣笛报警的“事故现场”。
将肿瘤变为“原位疫苗”:化疗与放疗的免疫学新视角
传统观念认为,化疗和放疗是通过其细胞毒性直接杀死快速分裂的癌细胞。然而,危险理论告诉我们,这只是故事的一部分。这些疗法真正的威力,在于它们能够将肿瘤组织转变为一个“原位疫苗”(in situ vaccine)。
这个过程可以这样理解:
- 诱导ICD: 特定类型的化疗药物(如蒽环类、奥沙利铂)和放疗能够高效地诱导癌细胞发生免疫原性死亡,释放出大量的DAMPs和肿瘤抗原(癌细胞特有的蛋白质片段)。
- 激活“哨兵”: 肿瘤微环境中的树突状细胞被DAMPs激活,同时吞噬并处理这些垂死癌细胞释放的肿瘤抗原。
- 递呈情报: 被激活的树突状细胞会迁移到附近的淋巴结,将捕获的肿瘤抗原“呈报”给T细胞——免疫系统中的“杀手部队”。
- 训练“杀手”: T细胞在接收到“敌人”的情报后,被激活并大量增殖,成为能够特异性识别并杀死癌细胞的杀伤性T细胞。
- 全身清剿: 这些被“训练”好的T细胞会进入血液循环,奔赴全身各处,不仅能攻击原发灶的残余癌细胞,还能找到并清除远处的转移灶。
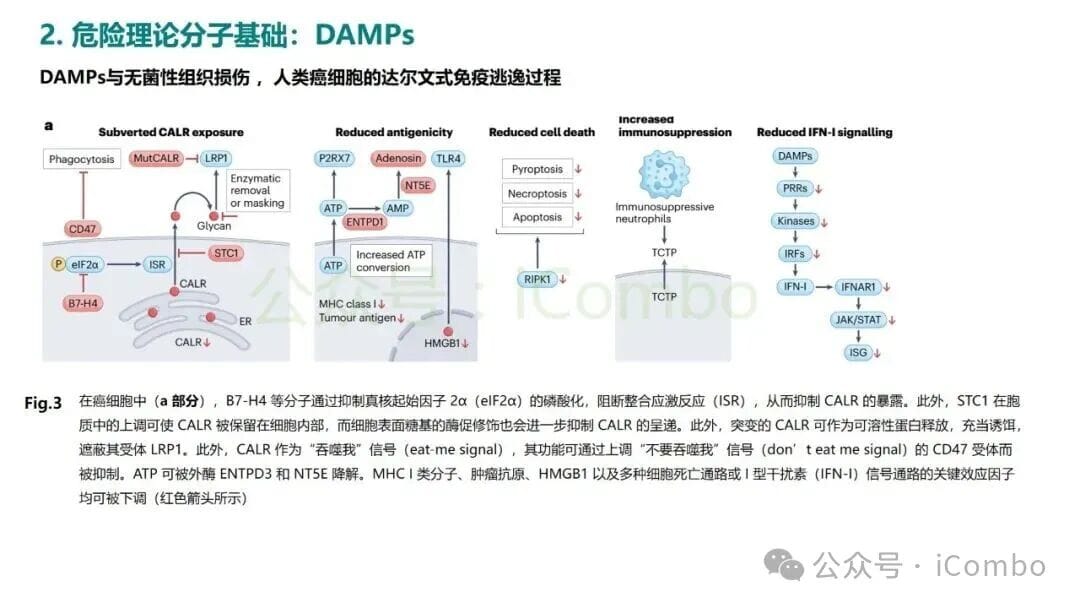
因此,化疗和放疗的成功,很大程度上依赖于其能否启动这个“诱导ICD → 激活免疫”的良性循环。反之,癌细胞为了生存,也会进化出各种策略来抑制DAMPs的释放,或营造一个免疫抑制的微环境,从而逃避免疫系统的监视和攻击。了解最新的癌症治疗方案和药物信息,可以帮助患者和医生做出更明智的决策。MedFind致力于提供全球前沿的抗癌资讯,您可以通过我们的抗癌资讯板块获取更多信息。
超越二元对立:危险理论与“自我-非我”理论的融合
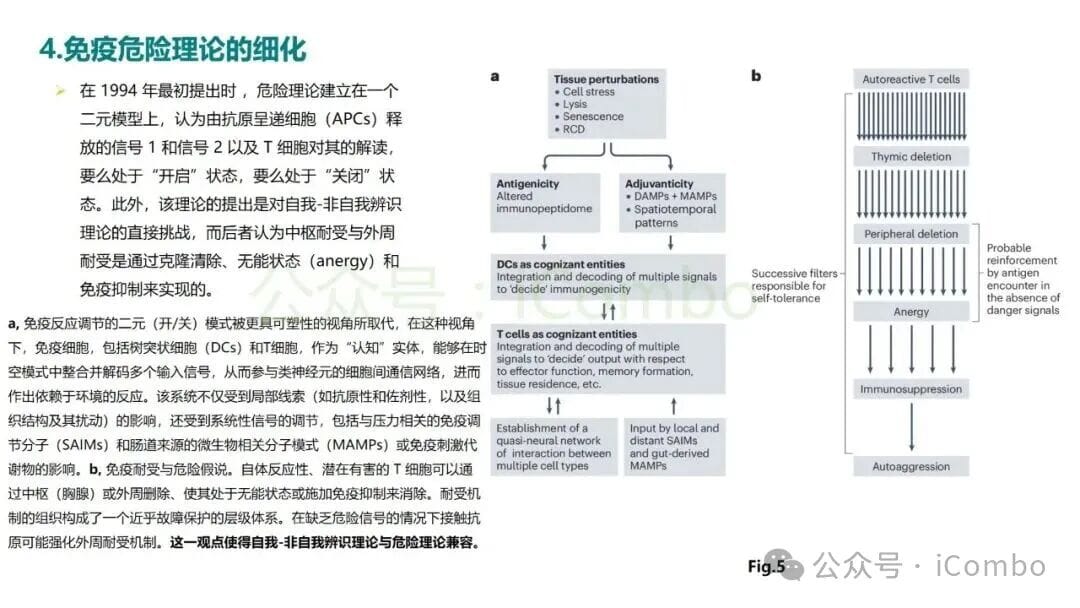
危险理论的提出,并非要完全否定“自我-非我”识别理论,而是对其进行了重要的补充和修正。现代免疫学观点认为,免疫系统的决策过程是一个更加复杂和层次化的模型。
免疫应答的启动,可以看作是两个条件的结合:免疫原性 = 抗原性 + 佐剂性。
- 抗原性(Antigenicity): 指的是一个物质(如肿瘤抗原)能够被免疫细胞识别的特性,这属于“自我-非我”的范畴。
- 佐剂性(Adjuvanticity): 指的是能够激活免疫系统的“上下文”信号,这正是危险理论所强调的“危险信号”(DAMPs)或来自病原体的“MAMPs”(微生物相关分子模式)。
只有当一个“非我”或异常的“自我”抗原,在充满“危险信号”的环境中被免疫系统感知时,才会触发一场强有力的免疫攻击。否则,即使存在抗原,免疫系统也可能选择“无视”,形成免疫耐受。这种融合性的观点,更好地解释了为何免疫系统既能容忍无害的“非我”(如食物、共生菌),又能在特定条件下攻击异常的“自我”(如癌细胞)。面对复杂的治疗选择,与专业人士沟通至关重要。如果您对自己的治疗方案有疑问,或希望了解更多前沿疗法,不妨尝试MedFind的AI问诊服务,获取个性化的分析和建议。
对未来癌症免疫治疗的启示
危险理论不仅深刻地改变了我们对基础免疫学的理解,更为癌症免疫治疗的未来发展指明了方向。基于这一理论,科学家们正在探索一系列创新的治疗策略:
- 开发新型ICD诱导剂: 寻找或设计能够更高效、更安全地诱导肿瘤细胞发生免疫原性死亡的药物,从而最大化“原位疫苗”效应。
- 优化联合治疗方案: 将能够诱导ICD的传统疗法(如特定化疗、放疗)与免疫检查点抑制剂(如PD-1/PD-L1抗体)等现代免疫疗法相结合。前者负责制造“危险信号”和释放抗原,后者负责解除T细胞的“刹车”,两者协同作用,可以达到1+1>2的治疗效果。
- 设计更有效的治疗性疫苗: 在开发癌症疫苗时,不仅要包含肿瘤抗原,还必须加入强效的佐剂(模拟危险信号的物质),以确保能够充分激活免疫系统。
- 靶向DAMPs信号通路: 通过药物调节DAMPs与其受体的相互作用,增强抗肿瘤免疫反应或抑制自身免疫病中的过度炎症。
总而言之,从“识别异己”到“感知危险”,是免疫学领域一次深刻的认知革命。危险理论让我们明白,对抗癌症不仅是“杀敌”,更是要学会如何向我们的免疫系统正确地“报警”。随着对这些“危险信号”调控机制的深入研究,我们有理由相信,未来将涌现出更多、更有效的癌症免疫治疗手段,为广大癌症患者带来新的希望。随着科学的进步,越来越多基于新理论的靶向药和免疫药被开发出来。如果您需要获取相关的治疗药物,MedFind的药品代购服务可以为您提供安全、可靠的渠道。