食管癌治疗挑战与免疫疗法新希望
食管癌,特别是食管鳞状细胞癌(ESCC),是全球尤其在东亚地区高发的一种恶性肿瘤。由于其早期症状不明显,多数患者在确诊时已属晚期,导致预后普遍较差,五年生存率仅在15%至25%之间。传统的治疗方法面临瓶颈,而免疫治疗的出现为晚期食管癌患者带来了新的曙光。然而,并非所有患者都能从免疫治疗中获益,如何精准筛选出优势人群,是当前临床面临的重大挑战。
近期,中国医学科学院北京协和医学院的团队在《Signal Transduction and Targeted Therapy》上发表了一项重磅研究,通过构建食管癌的单细胞免疫图谱,深入解析了其肿瘤微环境(TME)的复杂性,并发现了能够预测免疫治疗反应的关键生物标志物。

解构食管癌的免疫微环境
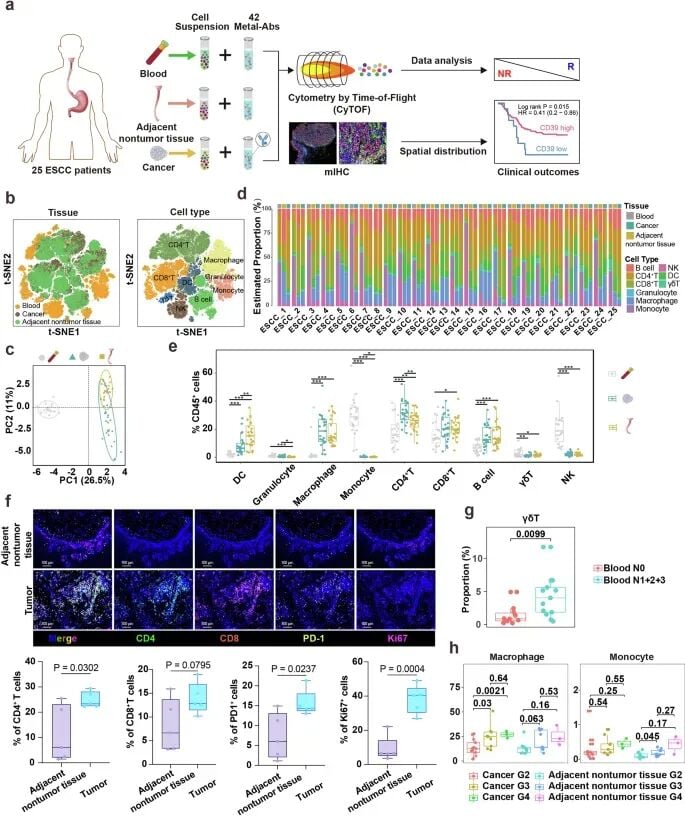
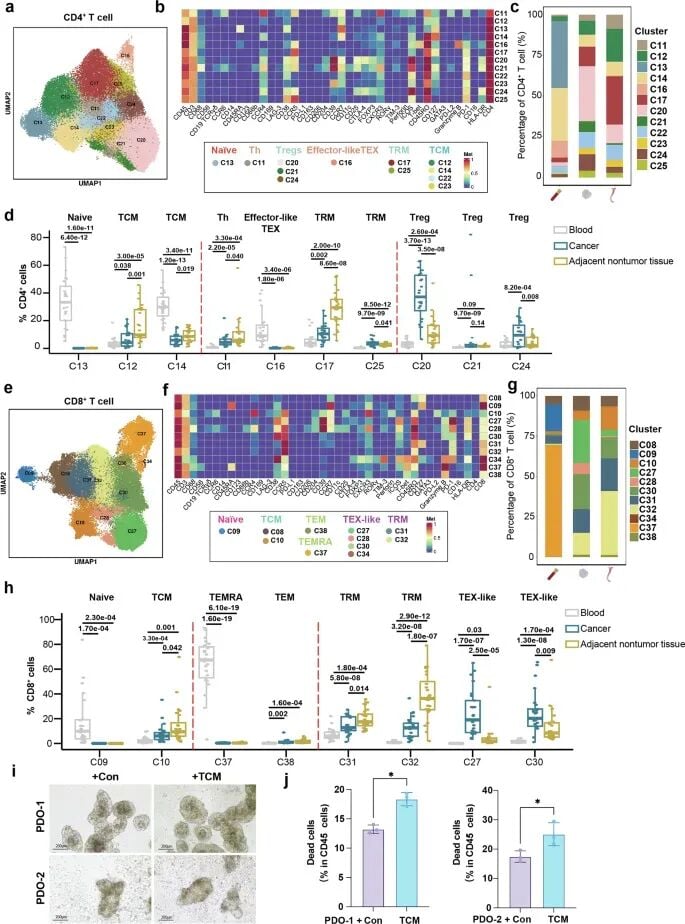
研究团队构建了一个包含超过1000万个细胞的庞大单细胞图谱,精细地描绘了食管癌肿瘤组织、癌旁组织及外周血中的免疫细胞景观。一个核心发现是,在ESCC肿瘤部位,能够发起有效抗肿瘤攻击的CD4⁺和CD8⁺中央记忆T细胞(TCM)显著缺失。这一现象揭示了食管癌免疫逃逸的重要机制之一。
T细胞亚群的“正邪之争”
研究进一步剖析了T细胞内部的复杂构成。结果显示,在食管癌肿瘤组织中,发挥免疫抑制作用的调节性T细胞(Tregs)大量浸润,占比高达48.5%,远超邻近非肿瘤组织(17.1%)。这些高度活跃的Tregs细胞如同“叛徒”,抑制了其他免疫细胞的杀伤功能。
与此同时,负责攻击肿瘤的CD8⁺ T细胞中,大量细胞处于“耗竭”状态(TEX),功能受损。这些发现共同描绘了一幅免疫系统在肿瘤微环境中“寡不敌众”的画面。令人鼓舞的是,体外实验证实,补充患者来源的TCM细胞能够重新激活对肿瘤细胞的杀伤反应,这为未来的细胞治疗策略提供了新思路。
预测免疫治疗反应的“信号灯”
这项研究最重要的成果,是找到了两个有望预测PD-1/PD-L1抑制剂疗效的潜在生物标志物。
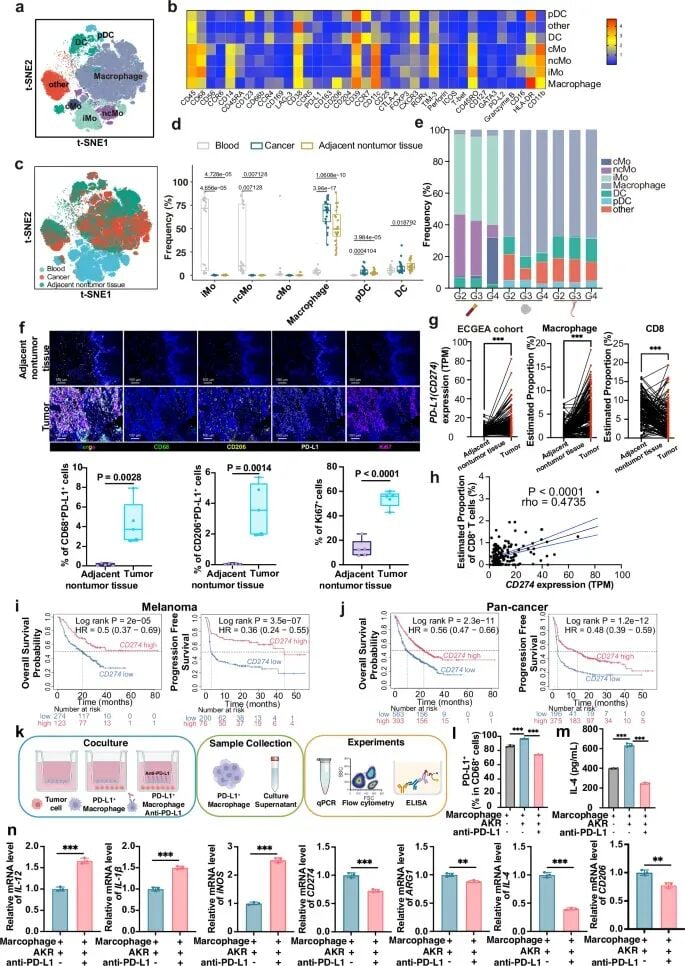
1. PD-L1⁺肿瘤相关巨噬细胞(TAMs)
研究发现,肿瘤微环境中的巨噬细胞(TAMs)高表达PD-L1与患者从免疫治疗中获得临床益处密切相关。更有趣的是,体外实验表明,使用PD-L1抑制剂不仅能阻断信号通路,还能将这些巨噬细胞“重新编程”,使其从抑制免疫的状态转变为促进免疫的促炎状态。这表明TAMs是免疫治疗的重要作用靶点。
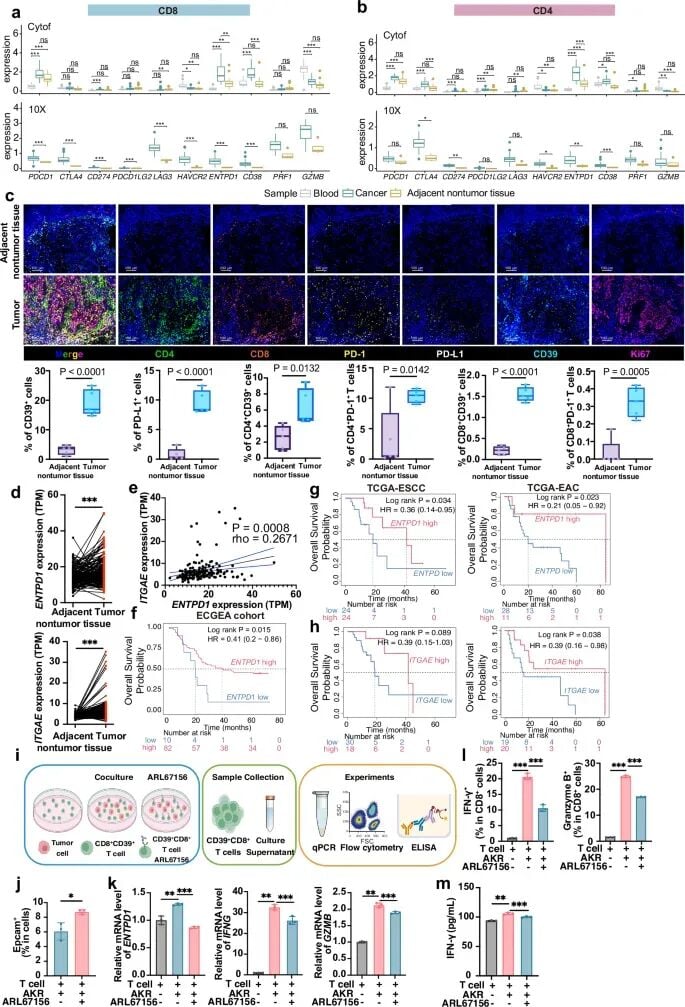
2. CD39⁺肿瘤浸润T细胞
研究团队发现,肿瘤浸润T细胞上CD39分子的高表达,是预测患者良好预后和对PD-1抑制剂高反应率的强力指标。功能实验也证实,抑制CD39的功能会削弱细胞毒性T细胞的抗肿瘤活性。这意味着,检测肿瘤浸润T细胞的CD39表达水平,有望成为筛选食管癌免疫治疗优势人群的有效手段。
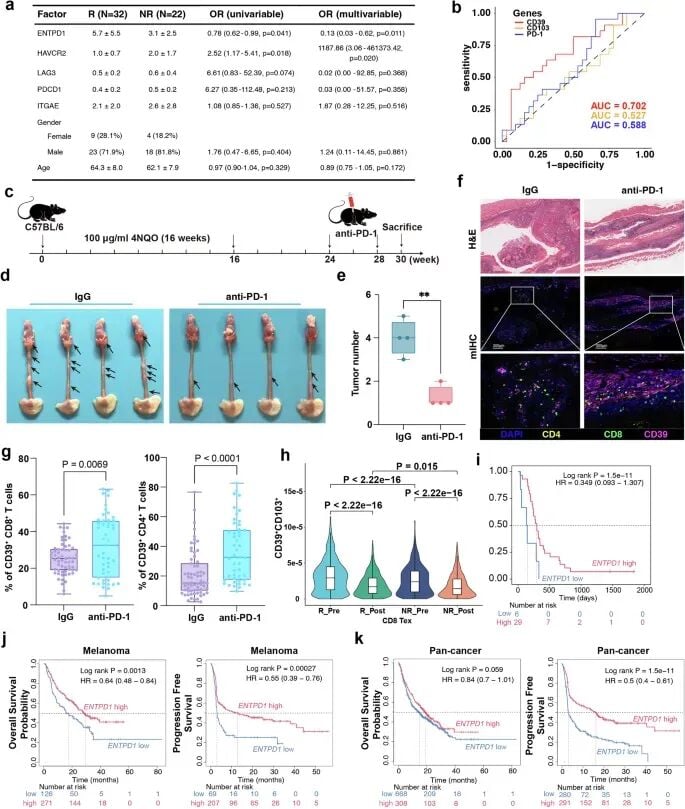
研究总结与临床启示
总而言之,北京协和医学院的这项研究为我们提供了一幅前所未有的高分辨率食管癌免疫图谱,不仅揭示了其独特的免疫逃逸机制,更重要的是发现了与免疫治疗疗效密切相关的关键细胞亚群和分子标志物(如CD39和PD-L1)。
这些发现为开发更精准的食管癌免疫治疗策略奠定了坚实的理论基础,未来通过综合分析这些生物标志物,有望为每一位患者量身定制最有效的联合治疗方案。如果您对自己的治疗方案或前沿疗法存在疑问,希望获得更多专业解读,可以尝试MedFind的AI问诊服务,获取个性化的第二诊疗意见。同时,如需了解相关免疫治疗药物的海外获取渠道与价格信息,可访问MedFind全球药房进行查询。