在抗击癌症的战役中,肿瘤抗原特异性CD8+ T细胞(即细胞毒性T淋巴细胞)被视为核心的免疫战士。然而,这些关键免疫细胞如何在全身范围内有效部署,以阻止癌症转移,一直是科学界亟待阐明的难题。
近日,来自中山大学孙逸仙纪念医院的宋尔卫院士和黄迪博士团队,在国际顶尖学术期刊《Developmental Cell》(《细胞》子刊)上发表了一项突破性研究。该研究深入揭示了肿瘤抗原特异性CD103+ CD8+ T细胞如何通过“远程部署”机制,有效抑制乳腺癌向肺部的转移,为乳腺癌治疗带来了新的希望。

免疫检查点阻断的挑战与新机制的探索
当前,免疫检查点阻断(ICB)疗法已在癌症治疗中取得显著成效,其原理在于重新激活患者自身的免疫细胞。通常,那些表现出“热肿瘤”特征(即免疫细胞广泛浸润)的患者,对ICB治疗的响应更佳。然而,许多肿瘤呈现“冷肿瘤”表型,由于肿瘤细胞与炎症细胞的复杂相互作用,导致效应T细胞浸润不足,从而对ICB治疗效果不佳。理解并克服这一障碍,是提升癌症免疫治疗效果的关键。
早在2022年,宋尔卫院士团队就提出了“效应免疫细胞布控(EICD)”这一创新概念,强调了效应免疫细胞在淋巴结、血液及肿瘤微环境中的启动、激活、循环、募集、浸润和存活过程,这对免疫系统有效监控和清除癌细胞至关重要。EICD的缺陷可能导致肿瘤免疫逃逸。尽管先天免疫在肿瘤转移防护中扮演着复杂角色,但原发肿瘤诱导的适应性免疫,特别是其远程部署机制,此前研究相对较少。这项新研究正填补了这一空白。
CD103+CD8+T细胞:抗击肿瘤转移的关键力量
值得关注的是,CD103+ CD8+ T细胞,这类具有组织驻留记忆表型的特殊T细胞,广泛存在于肺、皮肤等非淋巴组织中,并在局部免疫防御中发挥关键作用。研究发现,在非小细胞肺癌、乳腺癌和卵巢癌等多种实体瘤中,CD103+ CD8+ T细胞的丰富浸润往往预示着更好的临床预后,因为它们比其他CD8+ T细胞更有效地杀伤肿瘤细胞。然而,这些强大的免疫细胞在肿瘤转移过程中的具体作用机制,此前仍是一个谜团。
研究核心发现:远程部署与IDO1调控机制
宋尔卫院士团队的最新研究揭示了关键机制:他们发现,乳腺癌患者肿瘤引流淋巴结(TDLN)中肿瘤特异性CD103+ CD8+ T细胞的丰度,与更长的肺转移无病生存期显著相关。在小鼠模型中,研究人员进一步证实,这些CD103+ CD8+ T细胞在TDLN中被激活后,会通过CCL25/CCR9信号通路被精确招募到肺部,从而通过抗原特异性免疫反应有效抑制肿瘤转移。更重要的是,研究还发现肿瘤细胞在不同阶段释放的细胞外囊泡(EV),会动态调控肺泡巨噬细胞的极化,进而影响CCL25和IDO1的释放。其中,IDO1的升高会抑制肺部CD103+ CD8+ T细胞的部署,从而促进肺转移。令人鼓舞的是,有效抑制IDO1可以恢复CD103+ CD8+ T细胞对肺转移的保护作用。
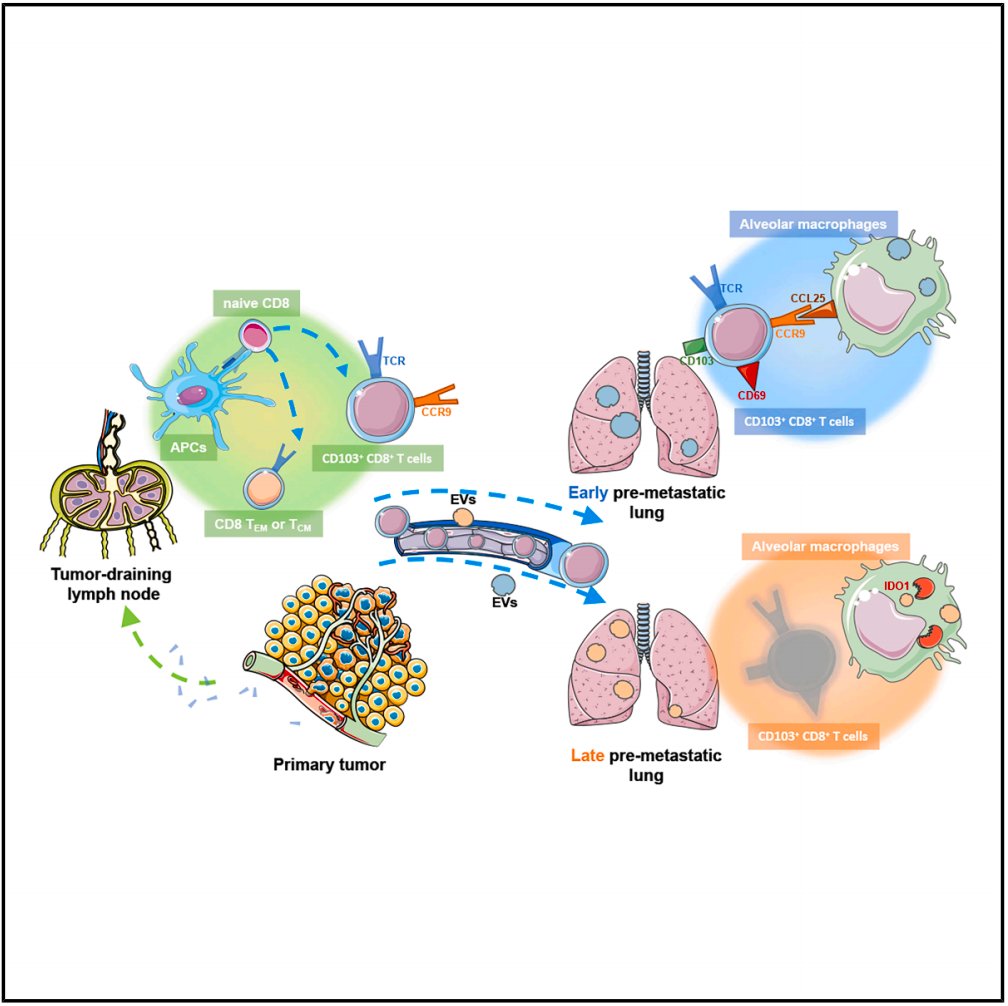
核心发现:CD103+CD8+T细胞如何抑制乳腺癌肺转移?
- 激活与迁移:抗原特异性CD103+CD8+T细胞在肿瘤引流淋巴结(TDLN)中被激活后,会定向迁移至肺部。
- 招募与抑制:肺泡巨噬细胞通过CCL25招募CD103+CD8+T细胞,但同时,通过IDO1的表达,可能导致T细胞功能受损甚至死亡。
- 肿瘤微环境调控:肿瘤细胞释放的细胞外囊泡(EV)在肿瘤转移的不同阶段,动态调控肺泡巨噬细胞的极化,从而影响免疫细胞的命运。
- 治疗潜力:增强CD103+CD8+T细胞的募集,或有效阻断IDO1的活性,有望成为遏制乳腺癌肺转移的新策略。
这项具有里程碑意义的研究,不仅深刻揭示了适应性免疫系统如何通过远程部署机制,有效保护远端器官免受肿瘤转移的侵害,更凸显了重建效应免疫细胞布控(EICD)在癌症治疗中的巨大潜力。对于乳腺癌等面临肺转移风险的患者而言,这一发现无疑带来了新的希望和治疗方向。未来,基于这些机制的靶向免疫疗法有望为患者提供更精准、更有效的治疗方案。如果您正在寻找最新的靶向药代购服务或AI问诊,MedFind致力于为全球癌症患者提供前沿的抗癌资讯与购药支持。