引言
脑胶质瘤是成人中最常见且最具侵袭性的原发性脑肿瘤,因其高度的异质性和独特的肿瘤微环境,治疗难度极大,患者五年生存率不容乐观。长期以来,医学界一直在寻找能够准确模拟真实肿瘤环境的实验模型,以加速新药研发和实现真正的个体化治疗。近日,一项联合研究取得了重大突破,为脑胶质瘤的精准治疗带来了新的曙光。
GlioME模型:攻克脑胶质瘤研究的关键瓶颈
由北京天坛医院与北京大学的顶尖团队联合开发的一种新型脑胶质瘤类器官模型(GlioME),成功解决了传统模型无法完整保留肿瘤微环境的难题。传统方法在培养类器官时,通常需要酶解处理,这会破坏肿瘤细胞与免疫细胞等微环境组分之间的重要相互作用,导致模型失真。
而GlioME模型采用了创新的培养方案:将手术切除的新鲜胶质瘤组织直接植入特殊的培养基质中。这种温和的方法首次在体外实现了胶质瘤细胞与其原始免疫微环境的共存,为研究肿瘤与免疫系统的复杂互动提供了前所未有的平台。

高度还原:GlioME如何真实模拟肿瘤微环境?
研究证实,GlioME模型在多个层面都高度还原了原始肿瘤的特征:
- 组织学特征:通过染色分析,GlioME模型展现了与患者肿瘤一致的细胞异质性和病理特征。
- 分子特征:全外显子测序和DNA甲基化分析表明,模型的基因组和表观遗传学特征与原始肿瘤高度吻合,包括关键的IDH1等基因突变状态。
- 免疫微环境:最关键的是,流式细胞术检测发现,GlioME模型中保留了大量的肿瘤相关巨噬细胞(CD68+)和T细胞(CD3+),其比例与原始肿瘤组织相当,这对于评估免疫治疗药物的疗效至关重要。
临床转化潜力:从实验室到个体化用药的桥梁
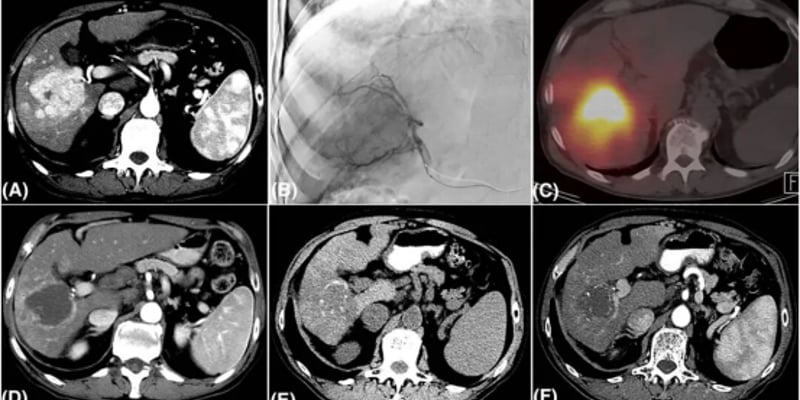
GlioME模型最令人振奋的应用价值在于其预测药物敏感性的能力。研究团队利用该模型测试了多种药物的疗效,包括标准化疗药物替莫唑胺(temozolomide),以及靶向药如pexidartinib(CSF1R抑制剂)和vebreltinib(MET抑制剂)。
结果显示,不同患者的类器官对药物的反应差异显著,这与临床观察到的个体化差异一致。其中一个典型的成功案例是:
一名携带MET基因扩增的脑胶质瘤患者,其GlioME模型在体外对MET抑制剂vebreltinib表现出极高的敏感性。基于这一预测,医生为患者制定了相应的治疗方案。令人鼓舞的是,患者在接受vebreltinib治疗两个月后,影像学检查显示肿瘤体积显著缩小,完美验证了GlioME模型的临床预测价值。

这一成果不仅证明了模型的准确性,也凸显了个性化靶向治疗在脑胶质瘤治疗中的巨大潜力。对于需要了解vebreltinib等前沿靶向药价格和购买渠道的患者,MedFind等专业平台提供了便捷的海外代购服务,帮助患者跨越信息和地域的障碍,及时获取有效的治疗选择。您也可以通过MedFind的AI问诊服务,获取更多关于您病情的个性化信息。
总结与展望
总而言之,GlioME模型的成功开发是脑胶质瘤研究领域的一项里程碑式进展。它突破了现有技术的局限,提供了一个能完整模拟肿瘤微环境的强大工具。这不仅有助于深入揭示脑胶质瘤的发病机制,更能用于精准的药物筛选和个体化治疗方案的制定,为脑胶质瘤患者的精准医疗带来了切实可行的新希望。