引言:探索癌细胞的“能量开关”
癌细胞为了维持其惊人的增殖速度,会重塑自身的代谢方式,其中对葡萄糖的依赖尤为突出。因此,“饿死”癌细胞的策略,如抑制葡萄糖的摄取,一直是癌症研究的热点。然而,单纯抑制葡萄糖转运蛋白(GLUTs)的药物在临床上效果并不理想,因为肿瘤细胞拥有复杂的应激机制。近期,一项发表于《血液学与肿瘤学杂志》的研究为我们揭示了一个全新的视角,发现了一种名为D-核糖-5-磷酸(D-ribose-5-phosphate, D5P)的代谢物,它如同一个精密的“代谢检查点”,能够直接调控关键的促癌蛋白YAP的活性,为结直肠癌等癌症的治疗带来了新的曙光。

YAP蛋白:癌细胞的“生存护身符”
YAP蛋白是Hippo信号通路中的核心效应分子,在正常情况下,它的活性受到严格控制。但在许多癌症中,YAP会异常激活,如同一个“护身符”,帮助癌细胞抵抗凋亡、促进增殖和应对外界压力。研究人员发现,当癌细胞处于葡萄糖受限的“饥饿”状态时,一些细胞系(如HCT116)中的YAP活性反而会增强,这是一种重要的自我保护机制。这项研究的核心正是要解开在能量胁迫下,细胞是如何调控YAP这个“生存开关”的。
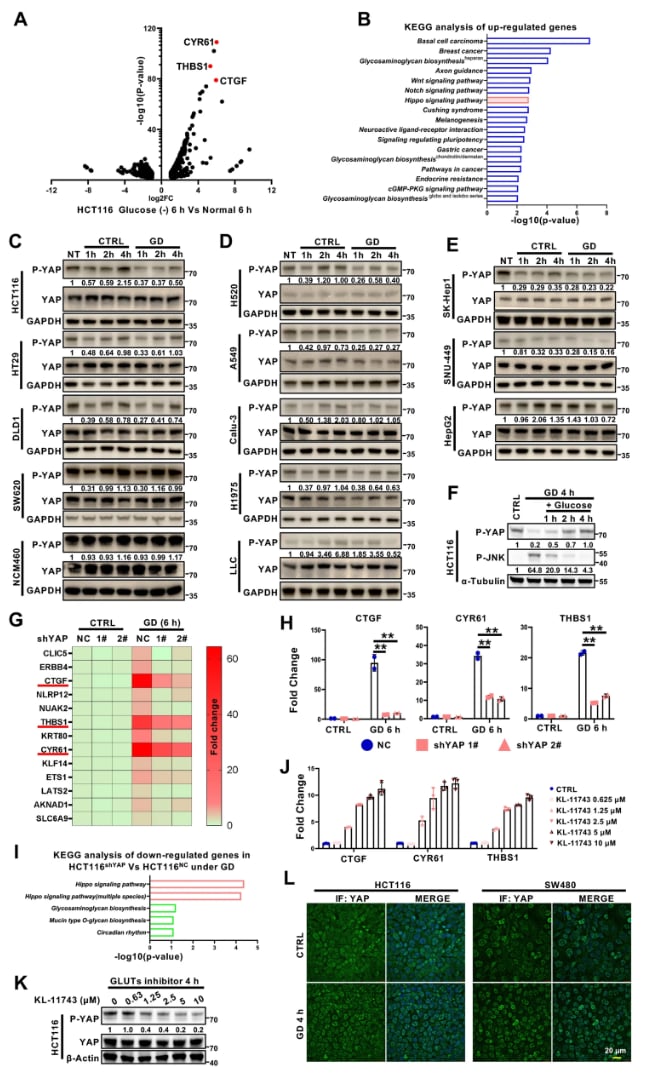
研究新发现:D5P是调控YAP活性的关键代谢信号
通过先进的代谢组学分析,研究团队发现了一个关键线索:
- 在葡萄糖受限时,YAP被激活的癌细胞中,D-核糖-5-磷酸(D5P)的水平显著下降。D5P是磷酸戊糖途径(PPP)的关键产物,连接着葡萄糖代谢和核苷酸合成。
- 当研究人员向“饥饿”的癌细胞中补充D5P时,能够有效地逆转YAP的激活状态,使其磷酸化水平恢复,并重新回到细胞质中,从而“关闭”其促进癌细胞生存的功能。
这一发现石破天惊,它表明D5P不仅仅是一个普通的代谢中间产物,更是一个能够感知细胞能量状态并直接调控关键信号通路的“信号分子”。

D5P如何“关闭”YAP?揭秘MYH9-LATS1调控轴
研究进一步揭示了其背后的精妙机制。正常情况下,LATS1激酶会磷酸化YAP,抑制其活性。但在葡萄糖缺乏、D5P水平下降时:
- 非肌球蛋白重链MYH9会与LATS1结合,导致LATS1蛋白发生聚集并通过自噬途径被降解。
- LATS1这道“刹车”被移除后,YAP便被释放和激活,进入细胞核,启动一系列促生存基因的表达。
- 而补充D5P则可以有效抑制MYH9与LATS1的相互作用,保护LATS1免于降解,从而恢复对YAP的抑制功能。
更有趣的是,研究还发现了一个负反馈环路:被激活的YAP会反过来促进核苷酸的降解,从而帮助恢复细胞内D5P的水平。这个精密的调控网络确保了癌细胞在面临代谢压力时,能够最大限度地利用YAP来维持生存。

D5P的抗癌潜力:从实验室到临床应用的前景
这项基础研究的发现,为癌症治疗,特别是结直肠癌的治疗,提供了极具吸引力的转化前景。
- 增强现有疗法效果:在细胞实验中,补充D5P能够显著增强葡萄糖转运(GLUT)抑制剂(如KL-11743)的抗癌效果,更有效地诱导细胞凋亡。
- 单独应用的抗癌活性:在携带APC突变(一种常见的结直肠癌驱动突变)的小鼠模型中,口服D5P能够显著减少肿瘤的数量和大小,降低其恶性程度,并延长小鼠的生存期。
- 临床相关性:对临床数据的分析也支持了这一机制的重要性,高表达相关代谢酶(如PNP)的患者预后更好,且其表达水平与YAP活性呈负相关。
这些结果表明,靶向“D5P-YAP”这一代谢信号轴,可能成为一种全新的癌症治疗策略。无论是作为单一疗法,还是与其他靶向药物联用,D5P都展现出了巨大的潜力,为苦苦寻求新方案的癌症患者带来了希望。


总结
总而言之,这项研究系统地阐明了D-核糖-5-磷酸(D5P)作为连接细胞代谢和信号转导的关键分子,通过调控MYH9/LATS1-YAP轴来控制肿瘤细胞命运的全新机制。这一发现不仅加深了我们对肿瘤代谢重编程的理解,也为开发基于代谢调控的抗癌新疗法,特别是针对结直肠癌等实体瘤的治疗,开辟了一条充满希望的新道路。





