引言:卵巢癌治疗的挑战——铂类耐药
卵巢癌,作为女性生殖系统常见的恶性肿瘤,其高致死率远超宫颈癌和子宫内膜癌,给无数家庭带来了沉重打击。尽管早期采用铂类药物(如顺铂)联合治疗对多数患者效果显著,但遗憾的是,仍有高达30%的患者在治疗后出现耐药,导致疾病复发,治疗难度剧增。因此,深入理解并攻克卵巢癌的铂类药物耐药机制,是当前临床和科研领域亟待解决的关键问题。
外泌体:细胞间的“信使”与肿瘤耐药
近年来,科学家们发现了一种微小的囊泡——外泌体,它们直径仅30-100纳米,存在于血液、尿液等多种体液中,被誉为细胞间信息传递的重要“信使”。外泌体携带蛋白质、核酸、脂质等多种生物分子,其独特的脂质双层结构能有效保护内容物,使其具有稳定的生物活性。研究表明,外泌体在肿瘤的发生发展中扮演着重要角色,甚至能影响肿瘤对化疗药物的敏感性。然而,在卵巢癌耐药过程中,外泌体中特定蛋白质的具体作用机制仍不完全清晰。
ISG15:卵巢癌铂类耐药的关键“推手”
为了揭示卵巢癌铂类耐药的深层秘密,一项最新研究利用蛋白质组学技术,对外泌体蛋白表达谱进行了深入分析。研究人员成功从卵巢癌敏感细胞和耐药细胞中提取并鉴定了外泌体,发现其中存在9个与铂类药物耐药显著相关的差异蛋白。通过进一步筛选和生物信息学分析,一个名为ISG15(干扰素刺激基因15)的关键分子浮出水面。研究结果显示,与敏感细胞相比,卵巢癌耐药细胞外泌体中ISG15的表达水平显著上调。更重要的是,示踪实验证实,这些外泌体能够被卵巢癌受体细胞有效摄取,并将高水平的ISG15传递给受体细胞,从而增强其对铂类药物的耐药性。

图1 外泌体表征的鉴定及蛋白质组学分析
Fig. 1 Characterization of exosomes and bioinformatics analysis of exosomal proteome
A: Western blot analysis of exosomal markers CD63 and TSG101. B: DLS analysis of exosomes. C: TEM analysis of exosomes. D: Heatmap of DEPs. E: GO analysis of DEPs. F: Venn diagram of PRR-genes, DEP-1 and DEP-2. G: Nine key proteins in the PPI network constructed by the STRING. DEP: Differentially expressed protein; PPI: Protein-protein interaction.

图2 ISG15通过外泌体进入卵巢癌细胞
Fig. 2 ISG15 was delivered to ovarian cancer cells through exosomes
A: ISG15 expression level in SKOV3-Exo and SKOV3DDP-Exo by Western blot. B: Representative fluorescent photos of ovarian cancer cells (SKOV3 and A2780) incubated with Dil-labeled exosomes (Dil in red and DAPI in blue). C: Schematic diagram of exosome entry into recipient cells. D: The SKOV3 cells were cocultured with SKOV3-Exo and SKOV2DDP-Exo, and the ISG15 expression level was detected by Western blot.

图3 外泌体中ISG15可增强卵巢癌细胞对铂类药物的耐药性
Fig. 3 Exosomal ISG15 improve platinum resistance in ovarian cancer cells
A: Knockdown of ISG15 in SKOV3DDP cell. B: The IC50 assay of A2780 nad SKOV3. Cells were incubated with PBS, SKOV3-Exo, SKOV3DDP-Exo and si-ISG15-Exo for 48 hours and analysis the cell viability by CCK-8 assays. C: Colony-formation assay shows the number of formed clones. Data were expressed as the x±s; n=3, *: P<0.05, **: P<0.01. NC: Negative control; N: Blank control.
揭示耐药机制:ISG15如何“操控”MDR1
这项研究进一步深入探讨了外泌体ISG15影响卵巢癌铂类药物耐药的具体分子机制。结果表明,ISG15可能通过激活PI3K/AKT/NF-κB信号转导通路,进而上调多耐药蛋白1(MDR1)的表达。MDR1编码的P-糖蛋白是细胞内重要的转运蛋白,其过度表达是导致肿瘤细胞对多种药物产生耐受的关键原因之一。当研究人员抑制PI3K/AKT/NF-κB通路时,MDR1的表达随之下降,进一步证实了这一通路在ISG15介导的耐药中的核心作用。这意味着,外泌体中的ISG15就像一个“指挥官”,通过这条信号通路“命令”细胞产生更多的MDR1,从而“泵出”化疗药物,使癌细胞对铂类药物产生抵抗。

图4 外泌体ISG15通过调节MDR1的表达影响EOC细胞的铂类药物耐药性
Fig. 4 Exosomal ISG15 affects the platinum resistance of EOC cells by regulating the expression of MDR1
A: Western blot showed the protein levels of PI3K, p-PI3K, AKT, p-AKT, NF-κB, p-NF-κB, MDR1 and GAPDH in EOC cells incubated with exosomes (SI-NC-Exos, SI-ISG15-Exos). B: The protein levels of proteins with inhibitors in EOC cells. Data were expressed as the x±s; n=3, *: P<0.05; **: P<0.01.
ISG15:卵巢癌铂类耐药的潜在预测标志物
除了机制研究,这项研究还探索了ISG15作为卵巢癌铂类药物耐药预测生物标志物的潜力。通过对87例卵巢癌患者的血清样本进行分析,研究人员发现,与铂类药物敏感患者相比,耐药卵巢癌患者血清外泌体中的ISG15表达水平显著升高。尽管血清中总ISG15水平差异不明显,但外泌体中的ISG15却能有效区分敏感和耐药患者,其预测效能良好(ROC曲线下面积为0.779)。这提示我们,检测血清外泌体中的ISG15,可能为卵巢癌患者的早期铂类药物耐药提供重要的预警信息,从而帮助医生及时调整治疗策略,避免无效治疗,为患者争取宝贵的治疗时间。

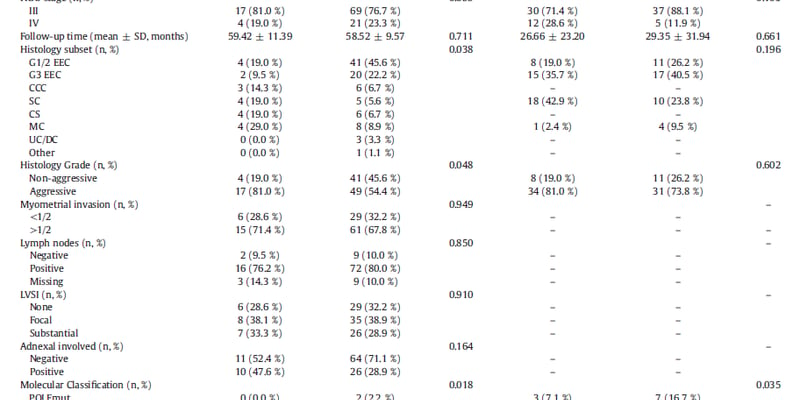
图5 卵巢癌患者入组及随访流程图
Fig. 5 Flowchart of EOC patients’ enrollment and follow-up

图6 EOC耐药患者血清外泌体中ISG15水平显著升高
Fig. 6 ISG15 levels significantly elevated in serum exosomes of platium-resistant EOC patients
A: Protein levels of ISG15, CD63 and TSG101 in serum exosome of insensitive patients and sensitive patients. B: ELISA revealed ISG15 concentration in serum and serum exosomes from sensitive patients and insensitive patients (sensitive: n=20, insensitive: n=20). C: Receiver operating characteristic curves of Exo-ISG15. Data were expressed as the x±s; ns: No significance. **: P<0.01.
展望:为卵巢癌患者带来新希望
这项研究为我们理解卵巢癌铂类药物耐药的复杂机制提供了新的视角,并指出了外泌体ISG15作为潜在生物标志物的重要价值。虽然研究仍有其局限性,例如样本量有待扩大,以及外泌体ISG15输送到受体细胞的具体机制尚需进一步阐明,但其发现无疑为卵巢癌的诊断和治疗带来了新的希望。未来,基于这些研究成果,我们有望开发出更精准的耐药预测工具,甚至探索针对ISG15或其相关通路的靶向治疗新策略,从而提高卵巢癌患者的治疗效果,改善预后。对于正在与卵巢癌抗争的患者而言,了解这些前沿研究进展,意味着在寻求有效治疗方案的道路上,又多了一份科学的指引和希望。