放疗面临的挑战:抵抗与副作用
放射治疗是癌症治疗的重要基石之一,全球近60%的肿瘤患者会接受放疗。它通过X射线诱导癌细胞DNA损伤和凋亡来消灭肿瘤。尽管放疗技术不断进步,已成为多种恶性肿瘤的标准疗法,但其局限性依然突出,主要体现在严重的副作用和肿瘤对放疗产生的抵抗性。如何有效降低放疗抵抗、减轻副作用并显著提升疗效,是当前癌症治疗领域亟待解决的难题。随着纳米医学的飞速发展,多功能纳米放疗增敏剂为增强肿瘤细胞对放射线的敏感性、提高放疗效果提供了新的策略。然而,现有纳米药物在临床应用中仍面临成本高昂、制备复杂、潜在毒性以及疗效不稳定的挑战。因此,开发一种高效、低毒且经济的新型放疗增敏策略至关重要。
自组装纳米药物的创新潜力
自组装纳米药物是一种通过小分子自发聚集形成具有特定结构和功能的稳定纳米体系。其核心优势在于无需外部载体,通过π-π堆积、疏水相互作用等非共价键协同作用维持结构稳定。这种基于小分子药物的自组装递送系统结合了前体药物和纳米技术的优点,具有载药量高、稳定性好、无外源载体毒性、肿瘤靶向性强等特点,已成为抗肿瘤药物递送研究的热点方向。
正是基于自组装纳米药物的巨大潜力,上海交通大学的袁苗苗、徐书祥教授与浙江大学的章荣俊教授团队联手,针对放疗增敏的瓶颈问题,创新性地设计并构建了一种名为AID的“智能自组装”纳米药物。AID由三种抗癌药物分子——阿托伐醌(ATO)、新吲哚菁绿(IR820)和多柔比星(DOX)自发组装而成。这项发表在国际顶级期刊《ACS Nano》上的突破性研究,旨在通过三重增敏机制(缺氧缓解+热疗增效+化疗协同)有效克服放疗抵抗,为肿瘤精准治疗提供了全新的范式。该研究成果以“Biodegradable Carrier-Free Nanomedicine via Self-Assembly of Pure Drug Molecules for Triple Sensitization of Radiotherapy”为题发表,DOI:10.1021/acsnano.4c15736。章荣俊、郭力豪、李青娇为共同第一作者,袁苗苗、徐书祥为共同通讯作者。

研究亮点与核心机制
这项研究的核心在于通过无载体自组装技术,将阿托伐醌(ATO,线粒体电子传递链抑制剂)、新吲哚菁绿(IR820,光热剂)和多柔比星(DOX,化疗药物)巧妙地组装成可生物降解的AID纳米药物。研究发现,AID通过π-π堆积和疏水作用自发形成粒径约75 nm的均一纳米颗粒,载药效率高(ATO 87%、IR820 11%、DOX 2%)。其显著优势在于:
- 无外源载体:避免了传统纳米载体可能带来的毒副作用。
- 优异的稳定性:在生理环境和血清中,AID纳米药物在12天内粒径和Zeta电位保持稳定,长期稳定性可达360天,展现出良好的临床转化潜力(图1)。

图1:自组装AID纳米药物的表征
通过分子模拟和分光光度实验,研究团队深入解析了AID的自组装机制,证实疏水相互作用和π-π堆积是驱动ATO、IR820和DOX分子形成稳定纳米结构的主要力量(图2)。

图2:分子模拟揭示了ATO、IR820和DOX之间的自组装机制
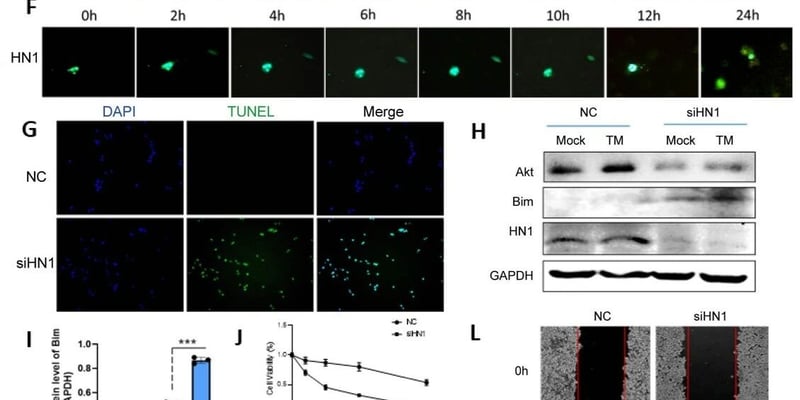
在细胞层面,AID纳米药物展现出强大的抗肿瘤活性。通过细胞生存活率、ROS、单线态氧和线粒体膜电位分析,研究证实AID在近红外光(NIR)照射下,通过以下三重机制协同增强放疗效果:
- 缺氧缓解:ATO作为线粒体抑制剂,能够破坏线粒体电子传递链,降低肿瘤细胞耗氧率,从而提升肿瘤微环境中的氧含量,改善乏氧状态,显著增强对放疗的敏感性。
- 热疗增效:IR820在NIR照射下产生温和热疗(42-45℃),促进肿瘤区域血管扩张,增加氧气和药物递送,进一步提升放疗效果。
- 化疗协同:DOX的释放能够诱导肿瘤细胞凋亡,与放疗产生时空上的协同作用,有效抑制肿瘤耐药性的产生(图3)。

图3:AID细胞水平破坏线粒体氧化呼吸链、改善乏氧和抑制肿瘤细胞生长
体内验证与临床转化潜力
基于细胞水平的积极结果,研究团队进一步在小鼠肿瘤模型中验证了AID纳米药物联合NIR和放疗的抗肿瘤效果。结果显示,AID + NIR + RT组合能够显著抑制肿瘤生长,促进肿瘤组织坏死,同时未观察到明显的全身性副作用。这再次证明了三重增敏协同机制在体内同样有效(图4)。

图4:AID纳米药物经NIR和放射治疗的体内抗肿瘤能力
这项研究的优异结果赋予了AID纳米药物从实验室走向临床的巨大潜力:
- 精准放疗增敏:特别适用于鼻咽癌、乳腺癌等对缺氧敏感的实体瘤,且能与现有放疗设备兼容。
- 诊疗一体化:IR820的光热特性同时具备近红外荧光成像能力,有望实现肿瘤的实时定位与疗效监测。
- 工业化前景:一步自组装的简单制备工艺和易得的原料,符合大规模生产的需求。
对于许多癌症患者而言,及时获取最适合的抗癌药或靶向药至关重要。在等待新疗法问世的同时,了解并获取已有的海外药物选项(包括创新药和仿制药)也是患者寻求更佳治疗方案的重要途径。MedFind海外靶向药代购网站致力于帮助患者寻找和获取全球范围内的抗癌药物。
结论与展望
面对高达60%的癌症患者需要放疗,但其中约40%因肿瘤缺氧和抵抗导致治疗失败的临床困境,这项研究提供了一个革命性的解决方案。AID自组装纳米药物通过首次实现三种机制的协同增敏,为放疗赋予了“智能导航”和“增效器”。它不仅显著提升了疗效,还避免了传统纳米药物的高毒性和复杂制备过程,为攻克实体瘤带来了新的曙光。
研究团队正积极推动AID纳米药物的临床转化研究,预计在3-5年内进入临床试验阶段。这项技术未来还有望拓展应用于肺癌、头颈癌等多种实体瘤的治疗。
面对复杂的癌症信息和治疗方案,患者往往需要专业的指导。MedFind提供的AI问诊服务和丰富的药物信息、诊疗指南等抗癌资讯,可以帮助患者更好地了解病情和治疗选择。