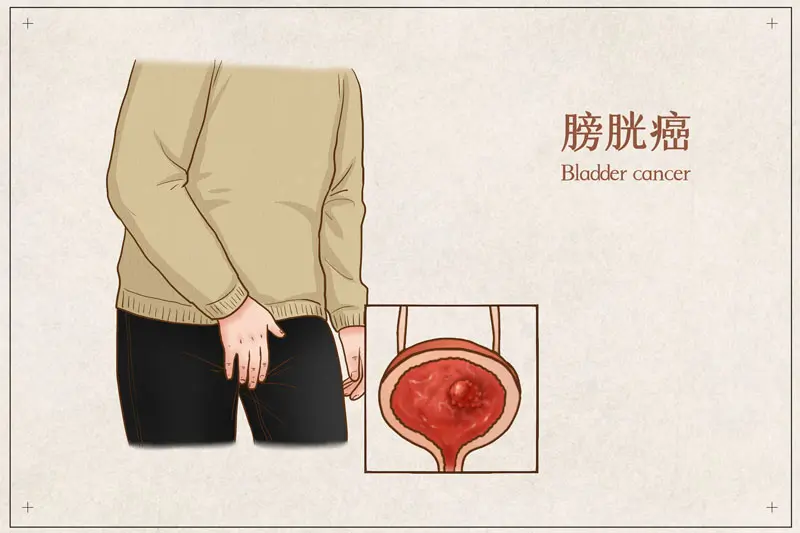
美国食品药品监督管理局(FDA)授予美国强生制药公司的新型靶向药物输送系统TAR-200突破性疗法认定,用于膀胱癌患者。该疗法在临床试验中展现强劲疗效,使得约80%的患者肿瘤完全消失!
突破性疗法认定(BTD):指美国食品药品监督管理局(FDA)对新药或新疗法的一种特殊授予,获得BTD的药物通常用于治疗严重或危及生命的疾病,并在早期临床试验中显示出相对于现有疗法更加显著的疗效。该认定旨在加速药物的研发和审批过程,以便更快地使患者受益。
1.TAR-200是一种新型靶向药物输送系统,可以将化疗药吉西他滨持续、可控地释放到膀胱中,并且可以在长达数周的时间内保持药物在膀胱内的浓度,持续产生疗效。
2.试验中,TAR-200单一疗法达到了非常惊艳的疗效,使得约80%的患者肿瘤完全消失!
3.93%的患者接受TAR-200治疗半年后疾病获得持续缓解,84%的患者接受TAR-200治疗一年后疾病获得持续缓解。
4.TAR-200治疗的安全性也很良好,大多数患者仅出现了比较轻微的副作用。
美国食品药品监督管理局(FDA)授予美国强生制药公司的新型靶向药物输送系统TAR-200突破性疗法认定,用于对卡介苗治疗无反应的高风险非肌层浸润性膀胱癌(NMIBC)患者,这些患者不适合或拒绝接受根治性膀胱切除术。
膀胱癌是一种比较常见的癌症,主要由于异常的膀胱癌细胞侵入并破坏了正常的身体组织。
其中,大约有75%的膀胱癌为非肌层浸润性膀胱癌(NMIBC)。这类癌症表现为癌细胞存在于膀胱浅层,尚未侵入到膀胱更深处或扩散到身体的其他部位。
高风险NMIBC约占NMIBC的15-44%,特点是级别高、肿瘤体积大、存在多发性肿瘤和原位癌。与低风险和中风险NMIBC相比,高风险NMIBC更有可能复发或扩散到膀胱内壁(尿路上皮)以外,并进展为浸润性膀胱癌。
对于高风险NMIBC患者,免疫疗法卡介苗是其一线标准疗法,但超过50%的患者接受卡介苗治疗一年内会出现疾病进展和复发,进而对卡介苗产生耐药性。
另外还有一部分NMIBC患者对卡介苗治疗无反应,这类患者目前的标准治疗手段是根治性膀胱切除术,如果在进展为浸润性膀胱癌之前进行手术,患者的预估生存率超过90%。但有些患者不适合或不愿意接受根治性膀胱切除术。高复发率和进展率可能给NMIBC患者带来严重的并发症和痛苦。这类患者急需有效的治疗选择。

来源:摄图网
TAR-200是一种靶向药物输送系统,可以将化疗药吉西他滨持续、可控地释放到膀胱中,并且可以在长达数周的时间内保持药物在膀胱内的浓度,持续产生疗效。
TAR-200旨在解决高风险非肌层浸润性膀胱癌(NMIBC)患者在接受卡介苗治疗后出现复发或疾病进展的未满足需求,这类患者目前的治疗选择十分有限。
TAR-200代表了一种治疗膀胱癌的新型介入方法,标志着在膀胱癌治疗方式转变和创新方面迈出了重要一步。
TAR-200获得突破性疗法认定得到了2b期SunRISe-1试验(NCT04640623)的结果支持。
该试验是一项开放标签、随机、2b期研究,纳入了大约200名高风险非肌层浸润性膀胱癌(NMIBC)原位癌患者,伴有或不伴有乳头状瘤病。患者必须年满18岁,ECOG表达评分为0至2,意味着身体状况良好,对卡介苗治疗无反应,也无法接受根治性膀胱切除术。
-
队列1患者接受TAR-200加Cetrelimab(西利单抗)治疗
-
-
队列3患者接受Cetrelimab(西利单抗)单药治疗
该试验还有第4个队列,患者为高风险非肌层浸润性膀胱癌非原位癌患者,伴有乳头状瘤病,接受TAR-200单药治疗。
注:Cetrelimab(西利单抗)是一款PD-1抑制剂,也是由美国强生制药公司生产,目前正在研究用于膀胱癌、前列腺癌、黑色素瘤和多发性骨髓瘤的联合治疗。
TAR-200在前24周的治疗中,每3周给药一次,然后每12周给药一次,直到第96周。
队列1、队列2和队列3的主要研究终点是完全缓解率(CR)。关键次要终点包括平均缓解持续时间(DOR)、总生存率、安全性和耐受性。队列4的主要研究终点是无病生存期。
该试验队列2的数据结果已经在2023年欧洲肿瘤内科学会(ESMO)上公布。
研究结果表明:TAR-200在患者群中引发了强劲且持久的疗效。在可评估的高风险非肌层浸润性膀胱癌(NMIBC)原位癌患者中,TAR-200单一疗法达到了76.7%的完全缓解率(CR),即有76.7%的患者肿瘤完全消失。研究人员预估整体的完全缓解率(CR)为80.0%,即有80.0%的患者肿瘤完全消失,疗效非常惊艳!
治疗有效的患者中,平均随访时间为48周,平均缓解持续时间(DOR)尚未达到。
在平均随访6个月时,预估的疾病缓解率(指患者接受治疗后疾病症状或体征得到缓解的比例)为93%。平均随访12个月时,预估的疾病缓解率为84%。
截至数据截止日期2023年8月24日,23名疾病获得缓解的患者中,有21名患者仍持续获得缓解。其中,11名患者的缓解持续时间为至少6个月,6名患者的缓解持续时间为12个月。
队列2中患者经历的大多数不良事件为比较轻微的1级或2级。大约一半(53.7%)的患者经历了至少1种与治疗相关的不良事件。1名患者经历了至少1次严重的不良事件。4名患者经历了3级及以上不良事件。
蕞常见的不良事件包括尿频、排尿困难、尿急、血尿、非感染性膀胱炎、尿路疼痛、尿潴留、肾功能损害和尿脓毒症。
两名患者因不良事件停止治疗。没有患者因治疗导致死亡。
3期SunRISe-2研究(NCT04658862)正在评估与放化疗相比,TAR-200与Cetrelimab(西利单抗)联合治疗肌层浸润性膀胱癌(MIBC)患者的的安全性和有效性。
2期SunRISE-4研究(NCT04919512)正在评估与仅适用Cetrelimab(西利单抗)相比,TAR-200与Cetrelimab(西利单抗)联合使用治疗肌层浸润性膀胱癌(MIBC)患者的安全性和有效性。
3期SunRISe-3研究(NCT05714202)正在招募未接受过卡介苗治疗的高风险非肌层浸润性膀胱癌(NMIBC)患者,以进一步评估与接受卡介苗治疗相比,TAR-200单独使用或与Cetrelimab(西利单抗)联用的安全性和有效性。
[1]https://www.onclive.com/view/fda-grants-breakthrough-therapy-designation-to-tar-200-for-bcg-unresponsive-high-risk-nmibc
[2]https://www.jnj.com/johnson-johnsons-investigational-tar-200-granted-u-s-fda-breakthrough-therapy-designation-for-the-treatment-of-high-risk-non-muscle-invasive-bladder-cancer