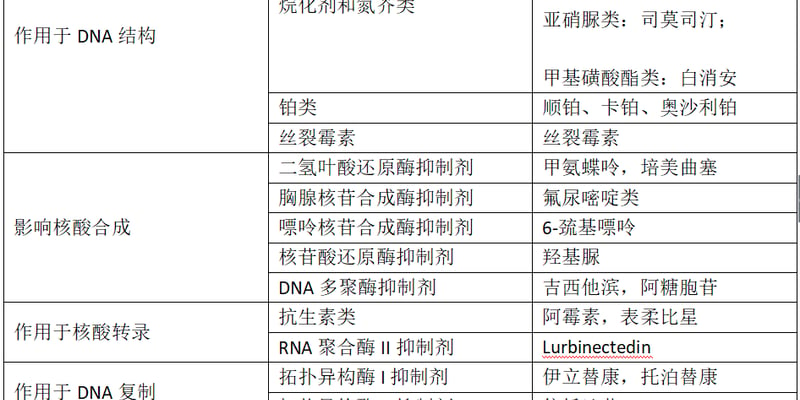
黏液性卵巢癌(Mucinous Ovarian Carcinoma, MOC)是一种罕见且预后较差的卵巢癌亚型,约占所有上皮性卵巢癌的3%至10%。与更常见的浆液性卵巢癌不同,MOC对标准的铂类化疗通常反应不佳,这使得其治疗充满挑战。然而,随着精准医学的发展,针对MOC独特分子特征的靶向治疗和免疫疗法正带来新的希望。本文旨在为患者和家属深度解析黏液性卵巢癌的分子生物学特征,特别是高频出现的KRAS突变和HER2扩增,并详细介绍最新的靶向药物(如德曲妥珠单抗、Adagrasib)和免疫治疗策略,帮助患者了解前沿的治疗选择、潜在的药物疗效,以及如何通过AI辅助问诊服务获取个性化的治疗建议。
黏液性卵巢癌(MOC)的独特生物学特征与挑战
卵巢癌并非单一疾病,而是由多种组织学亚型构成,每种亚型都有不同的临床表现和分子驱动因素。MOC的罕见性、诊断的复杂性以及对传统化疗的耐药性,是其治疗面临的主要挑战。
MOC的分子图谱:KRAS与HER2是关键靶点
MOC的分子特征与浆液性卵巢癌(SOC)存在显著差异。了解这些分子变异是实施精准治疗的基础:
- KRAS突变:这是MOC中最常见的基因变异,发生率高达43.6%至64.9%。KRAS突变与铂类耐药性密切相关,并且是预后不良的最强预测因子之一。KRAS突变导致细胞信号通路持续激活,促进肿瘤生长。
- HER2扩增/过表达:约18.8%的MOC患者存在HER2扩增,在亚洲人群中这一比例可能更高(27.4%–33.3%)。HER2扩增是重要的靶向治疗指征。
- 其他突变:还包括TP53、CDKN2A、PIK3CA、BRAF、FGFR2等。
- 低免疫原性:与SOC相比,MOC通常缺乏BRCA突变和较低的同源重组(HR)缺陷,这意味着其对PARP抑制剂单药治疗的敏感性较低。
- PD-L1表达:约14%的MOC表现出相对高水平的PD-L1表达,为免疫检查点抑制剂提供了潜在的治疗窗口。
这些独特的分子特征强调了对MOC进行亚型特异性研究和定制治疗策略的必要性。

图1:黏液性卵巢癌的发生率、基因变异、治疗反应和治疗靶点概述
MOC的标准治疗与局限性
MOC的治疗基础是综合治疗,包括手术和化疗。
手术治疗:细胞减灭术至关重要
手术的目的是确认诊断、确定分期并尽可能实现完全的细胞减灭术(R0切除)。对于早期MOC,彻底的手术切除往往能带来良好的治愈效果。对于晚期或无法完全切除的病灶,可能需要进行新辅助化疗(CT)后再进行间歇性减瘤手术。
化疗(CT):耐药性是主要障碍
标准的辅助化疗方案通常采用铂类药物(如卡铂)联合紫杉烷类(如紫杉醇)。然而,MOC对这种传统方案的耐药性较高。耐药机制复杂,包括多药耐药性(MDR)蛋白的过度表达、BRCA突变率低等。这促使临床研究必须转向基于分子靶点的创新疗法。
分子靶向治疗新策略:聚焦HER2与KRAS
鉴于MOC独特的分子谱,靶向治疗为克服化疗耐药性提供了新的方向。
1. HER2靶向治疗:ADC药物的突破
针对HER2扩增或过表达的MOC,抗体-药物偶联物(ADCs)代表了最前沿的治疗手段。ADC药物将靶向抗体与强效化疗药物偶联,实现精准打击。
德曲妥珠单抗(Trastuzumab deruxtecan, T-DXd)
德曲妥珠单抗(T-DXd)是一种新型的靶向HER2的ADC药物,由曲妥珠单抗、拓扑异构酶I抑制剂(DXd)和连接子组成。它不仅能靶向HER2阳性细胞,其释放的DXd还能作用于周围的癌细胞(旁观者效应),这对于HER2表达异质性的MOC尤其重要。
- 临床证据:在针对HER2过表达实体瘤的临床试验中,T-DXd显示出有希望的活性。尽管专门针对MOC的研究数量有限,但在HER2 3+亚组中观察到显著的客观反应率。有病例报告显示,ERBB2扩增的复发性MOC患者在接受卡铂-紫杉醇-曲妥珠单抗联合治疗和曲妥珠单抗维持治疗后,获得了长达三年的无复发生存期。
- 其他HER2靶向药物:正在研究的ADC药物还包括恩美曲妥珠单抗(T-DM1)和多曲妥珠单抗(SYD985)。此外,酪氨酸激酶抑制剂(如吡咯替尼)在曲妥珠单抗耐药的MOC患者中也显示出缓解潜力。
2. KRAS G12C抑制剂:从“不可成药”到精准靶向
KRAS突变在MOC中非常常见,但长期以来被认为是“不可成药”的靶点。针对KRAS G12C突变的抑制剂的出现,彻底改变了这一局面。
Adagrasib (Adagrasib)
Adagrasib是一种特异性靶向KRAS G12C突变体的抑制剂。它通过结合非活性的GDP结合构象,将KRAS捕获在其非活性状态,从而抑制其致癌信号传导。
- 疗效潜力:尽管目前缺乏针对MOC的临床试验数据,但在KRAS G12C突变的非小细胞肺癌等其他肿瘤中,Adagrasib显示出良好的疗效(确认部分缓解率53.3%,中位PFS 11.1个月)。鉴于MOC中KRAS突变的高频率,这种治疗策略具有巨大的临床探索价值。
- 药物获取:对于需要使用Adagrasib等尚未在国内广泛上市的创新药物的患者,可以通过国际医疗平台获取海外药物。例如,Adagrasib(商品名Krazati)可以通过合法的国际直邮渠道获取。
3. 其他潜在靶点抑制剂
- EGFR抑制剂:由于KRAS突变通常导致下游信号通路持续激活,抗EGFR药物(如西妥昔单抗)在KRAS突变肿瘤中的疗效会显著降低。
- Src通路抑制剂:MOC显示出高Src激酶活性。达沙替尼(Src抑制剂)联合奥沙利铂在临床前模型中显示出显著的抗肿瘤作用。
- 法尼基转移酶抑制剂(FTIs):如洛那法尼,旨在阻止KRAS的膜定位。然而,由于KRAS可以通过替代通路进行异戊二烯化,FTIs在MOC中的单独临床疗效有限。
免疫治疗策略:利用PD-L1表达窗口
免疫检查点抑制剂(ICIs)在多种癌症中取得了成功,但在MOC中的疗效相对温和,因为MOC总体上肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)较低。
免疫检查点抑制剂(ICIs)
约14%的MOC患者表现出高水平的PD-L1表达,这为使用PD-L1抑制剂(如帕博利珠单抗或阿替利珠单抗)提供了理论基础。
- 临床结果:针对晚期卵巢癌的荟萃分析显示,ICIs的疗效有限,但在PD-L1阳性细胞较多的复发性卵巢癌患者中,帕博利珠单抗可能带来益处。研究表明,将ICIs与标准化疗或抗VEGF药物联合使用,可以增强疗效。
- 挑战:MOC的肿瘤微环境可能存在免疫抑制(如高浓度的PD-L1-TAMs和T调节性细胞),这限制了单一免疫疗法的效果。未来的方向是结合通路抑制剂(如KRAS或Wnt通路抑制剂)来克服免疫排斥。
新兴免疫疗法:疫苗与CAR-T
- 癌症疫苗:针对mKRAS特异性的两亲物疫苗在KRAS突变率高的癌症(如胰腺癌、结直肠癌)中显示出潜力。这些疫苗具有广泛可用性且没有HLA限制。
- 过继性T细胞治疗(ACT):包括CAR-T细胞疗法,旨在增强患者自身的抗癌免疫机制。尽管针对MOC的研究较少,但针对晚期或复发性妇科癌症的ACT总体客观缓解率约为26.3%。
合成致死策略:克服MOC的耐药性
合成致死是一种精准肿瘤学策略,通过靶向一个在特定癌症突变存在时变得必不可少的基因,从而选择性地杀死肿瘤细胞。MOC独特的分子变异使其成为合成致死策略的理想目标。
1. PARP抑制剂的联合应用
PARP抑制剂(如奥拉帕利、尼拉帕利)是针对BRCA突变癌症的成功典范。然而,由于MOC缺乏BRCA突变和HR缺陷,PARP抑制剂单药治疗效果不佳。
- 联合策略:研究重点转向如何通过联合用药在BRCA正常的MOC中诱导合成致死效应:
- 与DNMT抑制剂联合:DNA甲基转移酶(DNMT)抑制剂可以破坏HR通路,模拟BRCA突变,从而增加对PARP抑制剂的敏感性。
- 与ATR抑制剂联合:ATR抑制剂可以使细胞对PARP抑制剂更敏感。
- 与酪氨酸激酶抑制剂联合:例如,尼拉帕利与安罗替尼(酪氨酸激酶抑制剂)联合在铂耐药OC患者中显示出抗肿瘤活性。
- 与PD-L1拮抗剂联合:尼拉帕利联合抗PD-1抗体(如帕博利珠单抗)在复发性铂耐药OC患者中显示出有希望的协同抗肿瘤活性。
- 与CDK4/6抑制剂联合:奥拉帕利与哌柏西利(CDK4/6抑制剂)联合,通过下调MYC诱导HR缺陷,可能对MYC过表达的MOC有效。
患者可以通过奥拉帕利和尼拉帕利的国际直邮服务,了解这些药物的海外价格和获取渠道,为联合治疗方案做准备。
2. 其他合成致死靶点
- ATR抑制剂:主要靶向HR缺陷的肿瘤。虽然大多数MOC是HR正常的,但对于具有ARID1A突变(约10.3%的MOC患者)的MOC,ATR抑制剂可能具有合成致死性。
- PLK1抑制剂:在具有错配修复(MMR)缺陷的MOC细胞系中,PLK1抑制剂(如onvansertib、volasertib)与紫杉醇或PI3K抑制剂联合使用显示出协同作用。MOC患者的MMR缺陷发生率高于浆液性卵巢癌。
- MEK抑制剂组合:MEK抑制剂(如曲美替尼、吡马替尼)与PI3K抑制剂联合使用,在KRAS突变的卵巢癌中显示出有希望的抗肿瘤活性。

图2:黏液性卵巢癌的新兴治疗策略
Wnt/β-连环蛋白通路及其他新兴靶点
多项研究揭示了MOC中其他失调的信号通路,为小分子抑制剂的开发提供了靶点:
- Wnt/β-连环蛋白通路:该通路在MOC中异常激活。靶向TFF1、PPA1、DKK1、LGR6和MARCH1等关键调节因子,可能有助于克服化疗耐药性。例如,TFF1升高与不良预后和顺铂耐药性相关。
- TET1:十一易位1(TET1)在EOC中起肿瘤抑制作用,其过表达可使Wnt/β-连环蛋白通路失活,抑制肿瘤生长。
这些研究强调了MOC生物学的复杂性,并为未来开发多靶点联合疗法提供了基础。
总结与展望:MOC治疗的未来方向
黏液性卵巢癌的治疗正在从传统的细胞毒性化疗向高度个性化的精准医疗迈进。MOC的罕见性和异质性是临床研究的巨大挑战,但针对KRAS、HER2等高频突变的靶向药物(如Adagrasib、德曲妥珠单抗)以及合成致死策略(如PARP抑制剂的联合应用),正在重塑MOC的治疗格局。
对于MOC患者而言,关键在于进行全面的分子谱分析,以确定是否存在HER2扩增、KRAS G12C突变或其他可利用的靶点。由于许多前沿药物仍在临床试验阶段或仅在海外获批,了解最新的临床研究进展和国际药物获取渠道至关重要。
未来的研究应侧重于:
- 开展专门针对MOC患者的大规模临床试验。
- 探索联合治疗方案,特别是靶向治疗与免疫治疗的组合,以克服免疫抑制和耐药机制。
- 继续挖掘合成致死靶点,利用MOC的突变特异性脆弱性。
通过持续的分子研究和创新的临床试验设计,我们有望显著改善黏液性卵巢癌患者的预后和生存质量。



表1:黏液性卵巢癌治疗方法的分子靶点、代表性药物和临床证据总结
如果您对黏液性卵巢癌的最新治疗方案、海外用药选择或药物价格有任何疑问,建议咨询专业的国际医疗服务平台,获取可靠的海外购药与直邮服务信息。