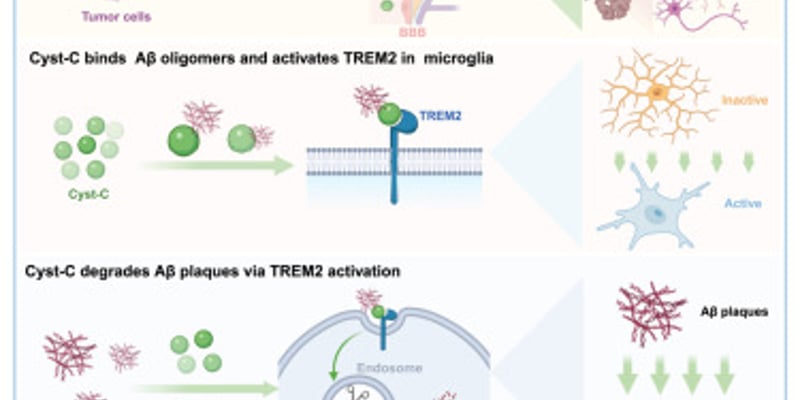
FDA监管政策迎来重大调整,CAR-T细胞疗法惠及更多血液肿瘤患者
美国食品药品监督管理局(FDA)近期宣布了一项里程碑式的决定:取消针对所有已获批的CD19和BCMA靶向自体CAR-T细胞免疫疗法的“风险评估和缓解策略”(REMS)要求。这一决策反映了肿瘤学界在识别和管理CAR-T治疗相关毒性方面日益增长的信心,预计将打破长期存在的社会经济、地理和后勤障碍,从而显著扩大这一创新疗法在血液系统恶性肿瘤患者中的可及性。
这项于2025年6月27日公布的监管更新,适用于治疗多发性骨髓瘤、特定类型淋巴瘤和白血病的多种CAR-T产品。此外,FDA还批准了对liso-cel和ide-cel的药品说明书更新,减少了患者在接受治疗后的部分监护要求。
哪些CAR-T疗法将受益于新规?
此次取消REMS要求的决定覆盖了以下六种前沿的CAR-T细胞治疗产品:
- Idecabtagene vicleucel (ide-cel; Abecma)
- Lisocabtagene maraleucel (liso-cel; Breyanzi)
- Ciltacabtagene autoleucel (cilta-cel; Carvykti)
- Tisagenlecleucel (Kymriah)
- Brexucabtagene autoleucel (Tecartus)
- Axicabtagene ciloleucel (Yescarta)
取消REMS意味着治疗中心不再需要经过特殊认证,也无需强制性地在现场随时备有托珠单抗(Actemra)等药物。FDA认为,鉴于临床经验的积累和管理指南的成熟,这些额外的保障措施对于维持这些疗法有利的风险-获益平衡已非必要。
数据驱动决策:为何现在放宽限制?
REMS计划最初旨在通过结构化的安全指南,帮助医生权衡治疗的利弊。对于CAR-T疗法,所有产品都带有关于细胞因子释放综合征(CRS)和神经毒性的黑框警告。然而,越来越多的证据表明,CAR-T疗法的安全性是可预测且可控的。
多项关键研究为此次政策调整提供了坚实的数据支持。例如,一项针对475名淋巴瘤患者的回顾性研究发现,在输注CAR-T细胞两周后,CRS的发生率为0%,而免疫效应细胞相关神经毒性综合征(ICANS)的发生率仅为0.7%。另一项针对129名多发性骨髓瘤患者的研究也得出了相似结论,两周后晚发性CRS和ICANS的发生率分别为0%和1.6%。
在2025年ASCO年会上公布的数据进一步证实,在超过1500名接受liso-cel治疗的B细胞恶性肿瘤患者中,96%的CRS和ICANS事件发生在前两周内。这些数据共同表明,需要立即进行专业护理的急性毒性反应绝大多数发生在输注后的初期,因此缩短监护期是合理且安全的。
为患者扫除障碍:新规带来的直接影响
专家一致认为,这些变化将立即对患者获得CAR-T治疗产生积极影响,有效缓解了与治疗管理相关的身体、后勤和经济负担。在此之前,严格的监护要求(如输注后需在治疗中心附近停留4周,以及长达8周的驾驶限制)使得许多社会经济地位较低或居住在偏远地区的患者无法获得这种可能挽救生命的疗法。
根据FDA的最新更新,驾驶限制缩短至2周,患者在输注后仅需在医疗机构附近停留2周。这一改变使得治疗过程“对于大多数患者及其照护者来说更具可行性”。如果您对CAR-T疗法或其它前沿抗癌方案有任何疑问,可以咨询MedFind的AI问诊服务,获取专业的个性化解答。
社区肿瘤治疗新模式:混合医疗的未来
REMS要求的取消也反映出肿瘤学界对管理CAR-T毒性的日益熟悉和专业。随着社区肿瘤科医生对CAR-T疗法的经验不断增加,未来有望形成一种“混合或整合的医疗模式”。在这种模式下,细胞输注和采集等核心环节仍在学术中心进行,而治疗前的准备工作和后续的长期监测则可以转移到社区医疗机构,从而进一步提升治疗的便利性。
长期安全性的考量:警惕仍是关键
尽管REMS被取消,但临床警惕性和长期的安全性监测仍然至关重要。根据FDA的现行指南,CAR-T疗法的制造商仍需进行上市后观察性安全研究,以评估长期风险,特别是继发性恶性肿瘤的发生风险。患者在接受治疗后将被随访15年。
此外,研究表明,尽管急性CRS和ICANS的管理已大为改善,但感染仍然是患者面临的主要风险之一,尤其是在治疗后的前几个月。因此,积极的预防措施,如监测免疫球蛋白水平和使用预防性抗生素,对确保患者长期安全至关重要。
CAR-T细胞疗法的未来展望
总而言之,取消CAR-T疗法的REMS计划是监管机构适应临床经验和数据成熟度的一个重要范例,也符合扩大先进细胞疗法可及性的宏观目标。随着CAR-T疗法的适应症不断扩展,加强学术中心与社区医疗机构之间的协作,将是确保其安全、广泛应用的关键。未来,CAR-T疗法有望像免疫检查点抑制剂一样,成为可在地方诊所常规施用的治疗手段,让更多患者受益。想要了解更多前沿的抗癌资讯,欢迎访问MedFind。
参考文献
- FDA eliminates Risk Evaluation and Mitigation Strategies (REMS) for autologous chimeric antigen receptor CAR T cell immunotherapies. FDA. June 27, 2025. Accessed August 14, 2025.
- U.S. Food and Drug Administration approves streamlined patient monitoring requirements and removal of REMS programs within Bristol Myers Squibb’s cell therapy labels. News release. Bristol Myers Squibb. June 26, 2025. Accessed August 15, 2025.
- Ahmed N, Wesson W, Lutfi F, et al. Optimizing the post-CAR T monitoring period in recipients of axicabtagene ciloleucel, tisagenlecleucel, and lisocabtagene maraleucel. Blood Adv. 2024;8(20):5346-5354. doi:10.1182/bloodadvances.2023012549
- Wesson W, Dima D, Suleman N, et al. Timing of toxicities and non-relapse mortality following CAR T therapy in myeloma. Transplant Cell Ther. 2024;30(9):876-884. doi:10.1016/j.jtct.2024.06.012
- Kamdar M, Shadman M, Ahmed S, et al. Optimizing post–chimeric antigen receptor (CAR) T cell monitoring: evidence across lisocabtagene maraleucel (liso-cel) pivotal clinical trials and real-world experience. J Clin Oncol. 2025;43(suppl 16):7026. doi:10.1200/JCO.2025.43.16_suppl.7026
- Ahmed N, Shahzad M, Shippey E, et al. Socioeconomic and racial disparity in chimeric antigen receptor T cell therapy access. Transplant Cell Ther. 2022;28(7):358-364. doi:10.1016/j.jtct.2022.04.008