引言
结直肠癌肝转移(CRLM)是导致患者死亡的主要原因之一,尽管治疗手段不断进步,但CRLM患者的预后依然严峻。其背后的分子机制极为复杂,传统的单组学分析方法(如仅分析基因组或转录组)难以全面揭示肿瘤的生物学全貌,常常会遗漏关键的治疗靶点。因此,开发一种能整合多维度数据的综合性方法,对于更深入地理解肿瘤、寻找新的治疗策略至关重要。
多维系统精准锁定关键基因
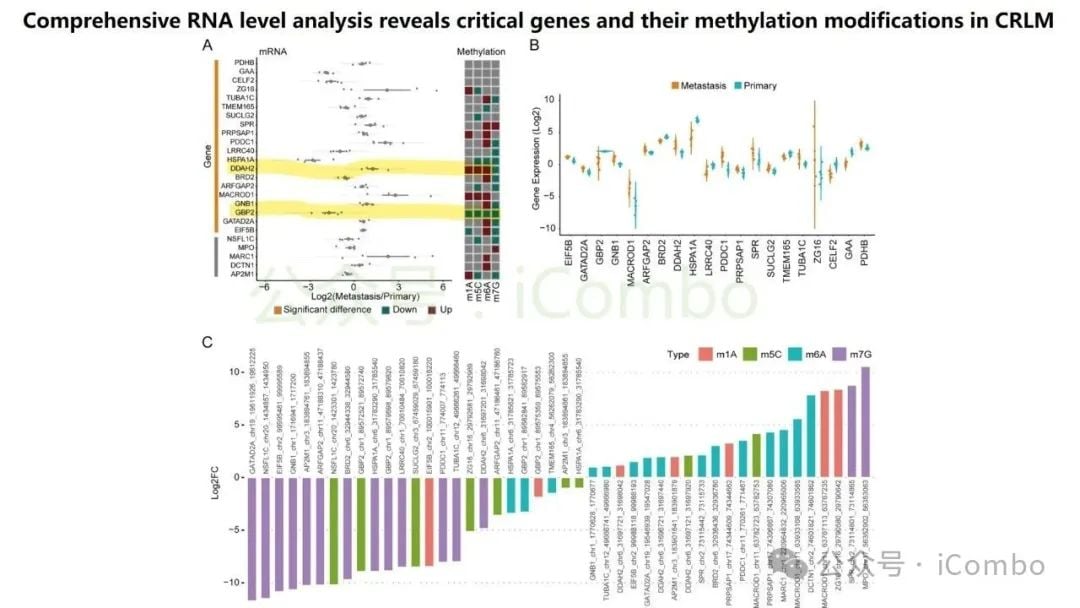
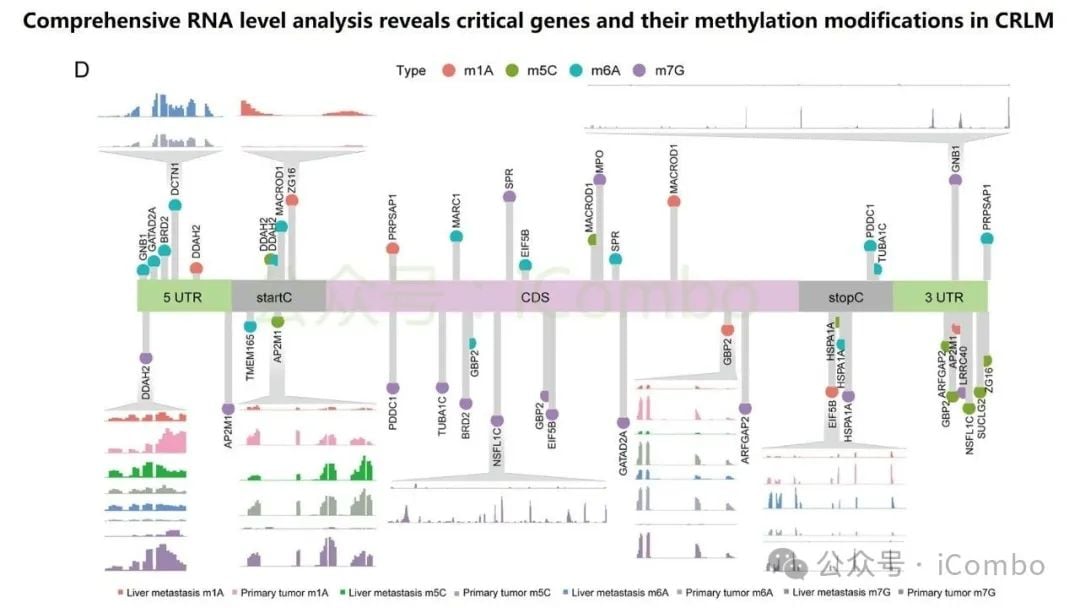
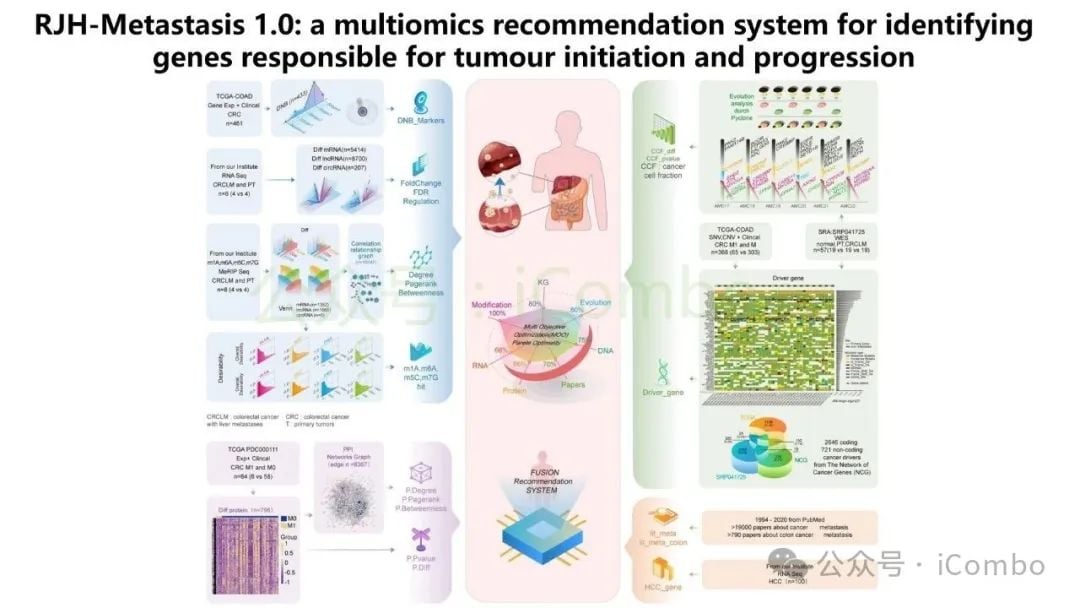
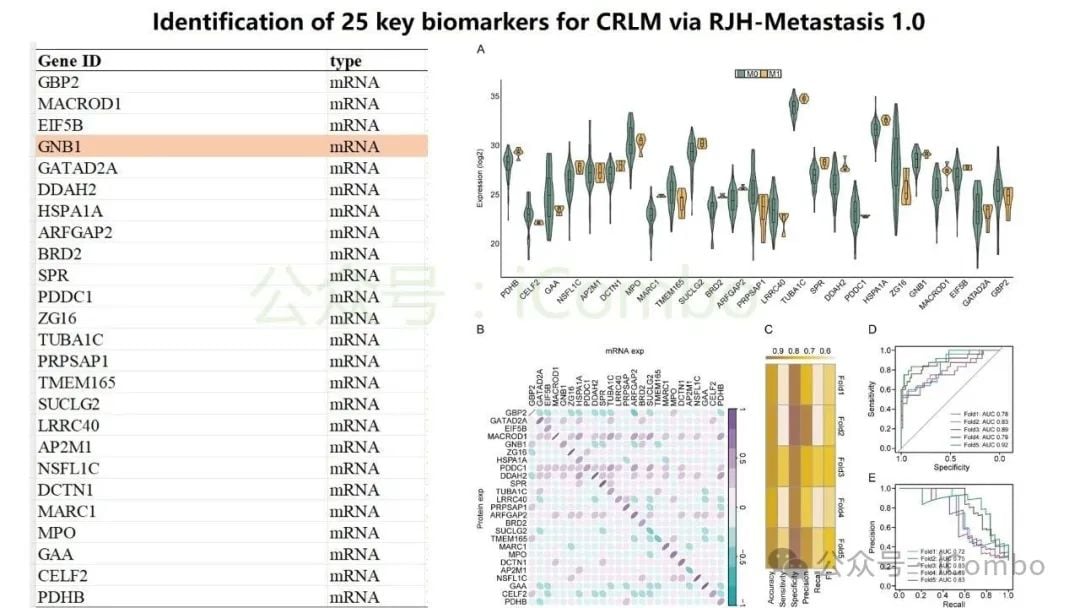
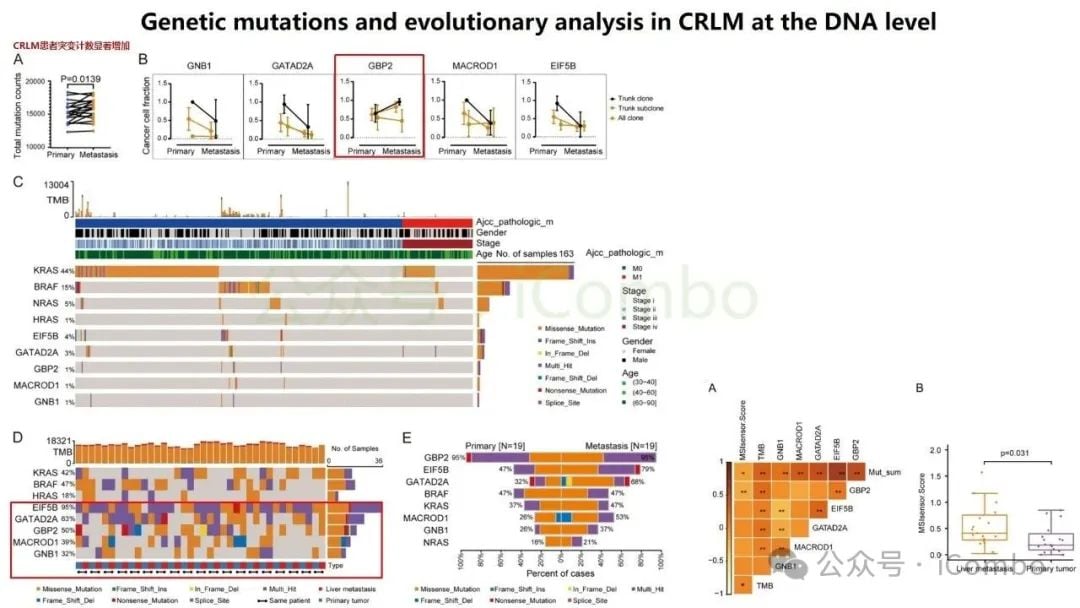
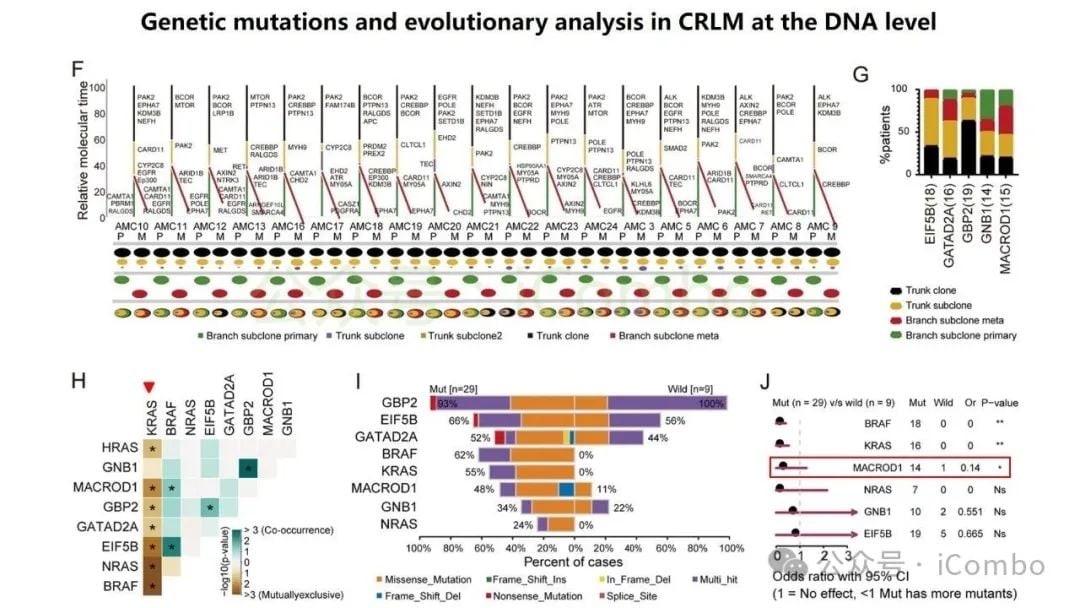
近期一项发表于《分子癌症》(Molecular Cancer)的研究为此带来了新思路。研究团队开发了一个名为“RJH-Metastasis 1.0”的多维推荐系统,该系统创新性地整合了基因组、转录组、蛋白质组和海量文献证据等多组学数据。通过对43个特征参数进行多目标优化,该系统成功筛选出25个与结直肠癌肝转移密切相关的基因。
在这些基因中,研究人员进一步验证了5个核心基因:GNB1、GATAD2A、GBP2、MACROD1和EIF5B。这些基因的发现,为理解肝转移的复杂过程以及开发新的治疗靶点提供了坚实的基础。


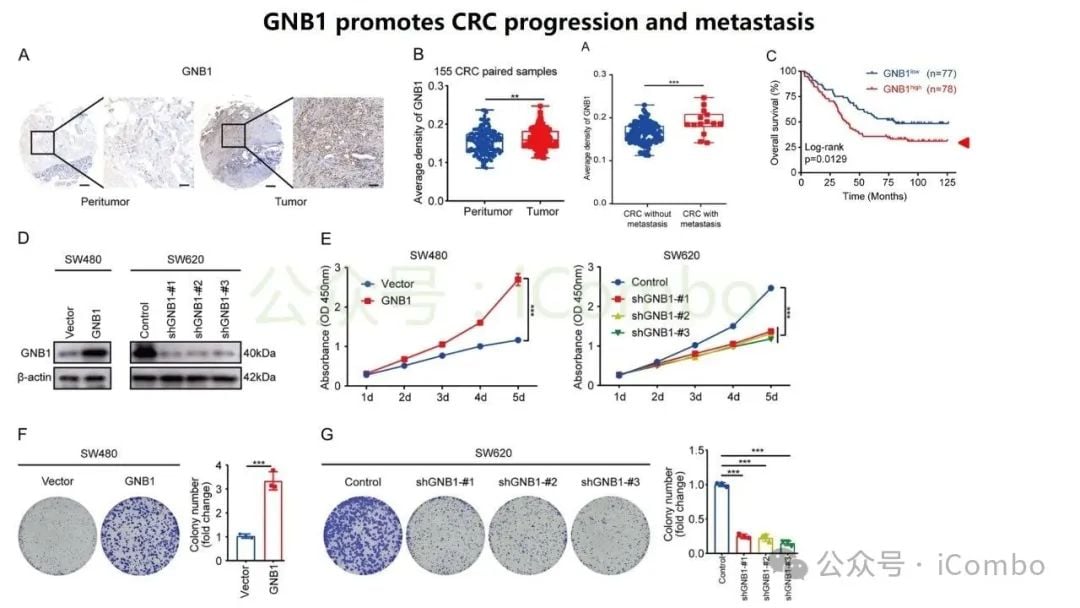
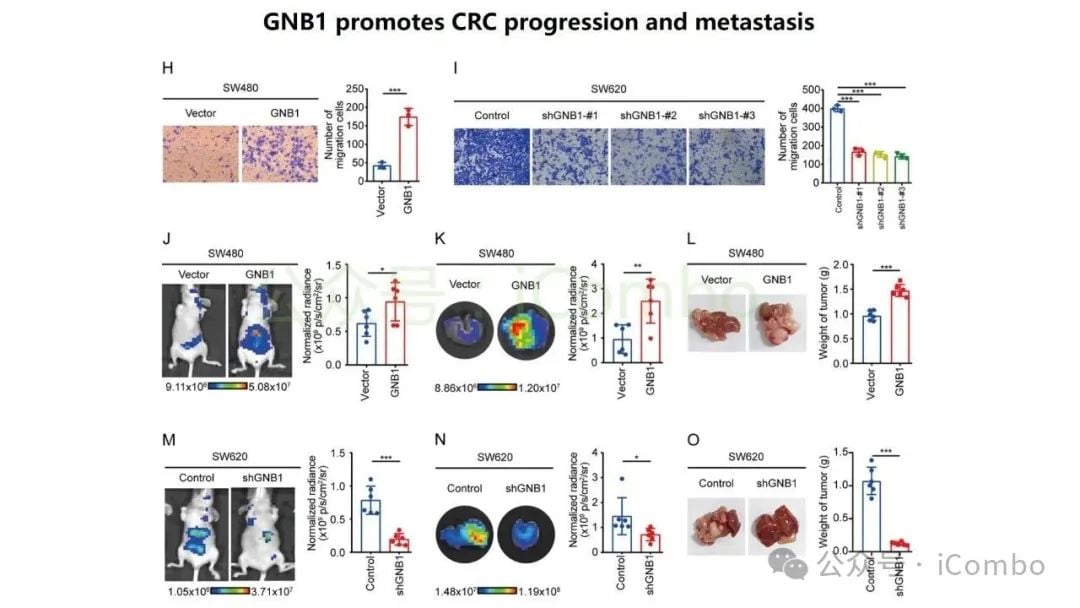
GNB1:调控肿瘤免疫微环境的核心
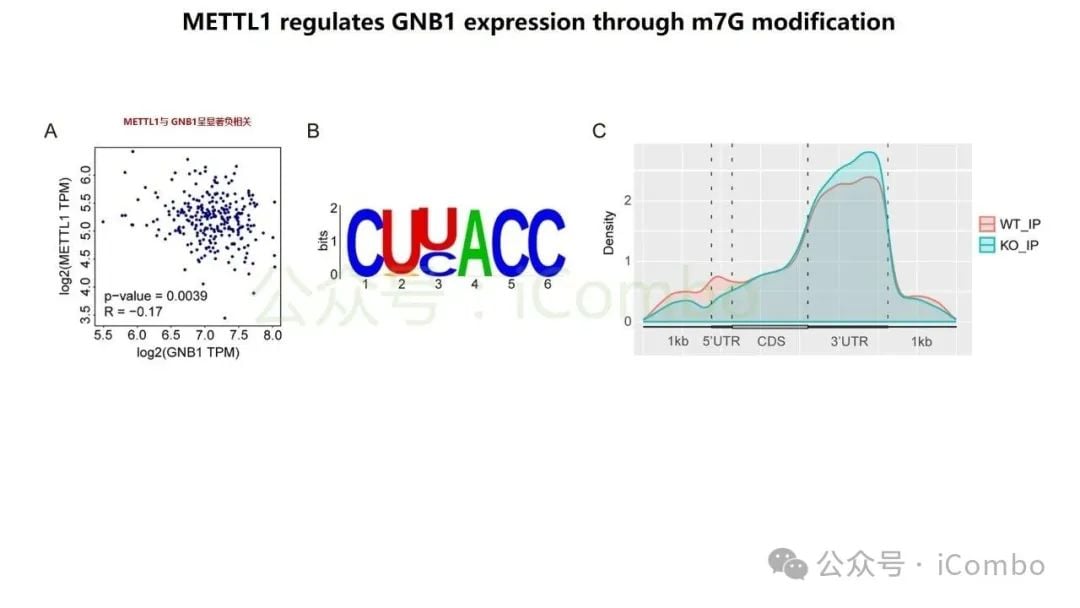
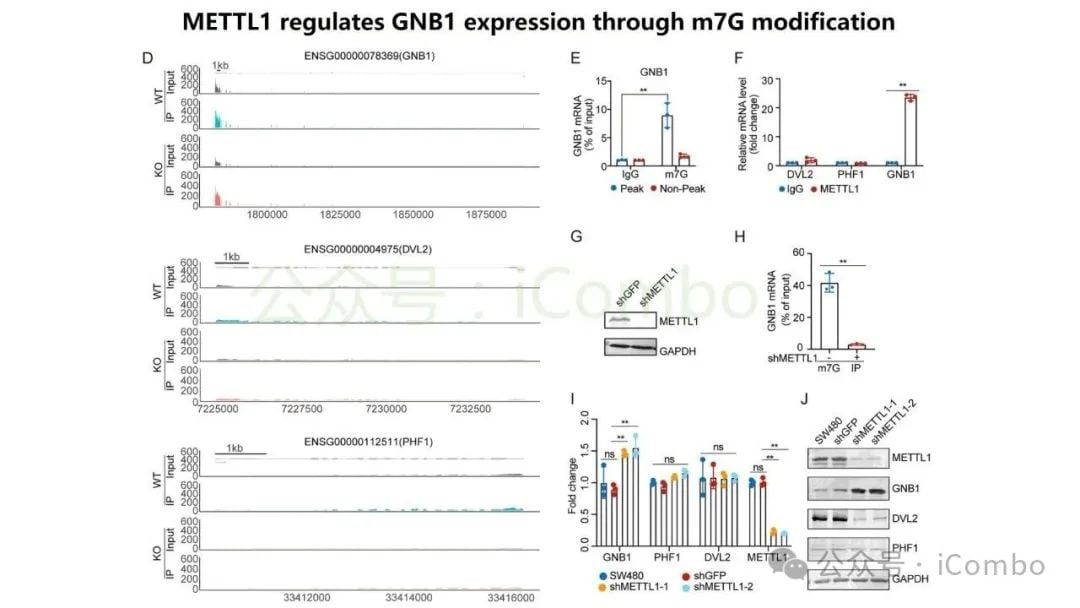
研究特别聚焦于GNB1基因,发现它在结直肠癌肝转移中表现出一种独特的调控模式:其DNA突变频率不高,但其RNA转录和蛋白质表达水平却显著上调。深入的机制研究揭示,GNB1的表达受到一种名为METTL1介导的m7G RNA修饰的调控。当METTL1基因被抑制时,GNB1信使RNA(mRNA)上的化学修饰会减少,从而促进其翻译成蛋白质的过程。
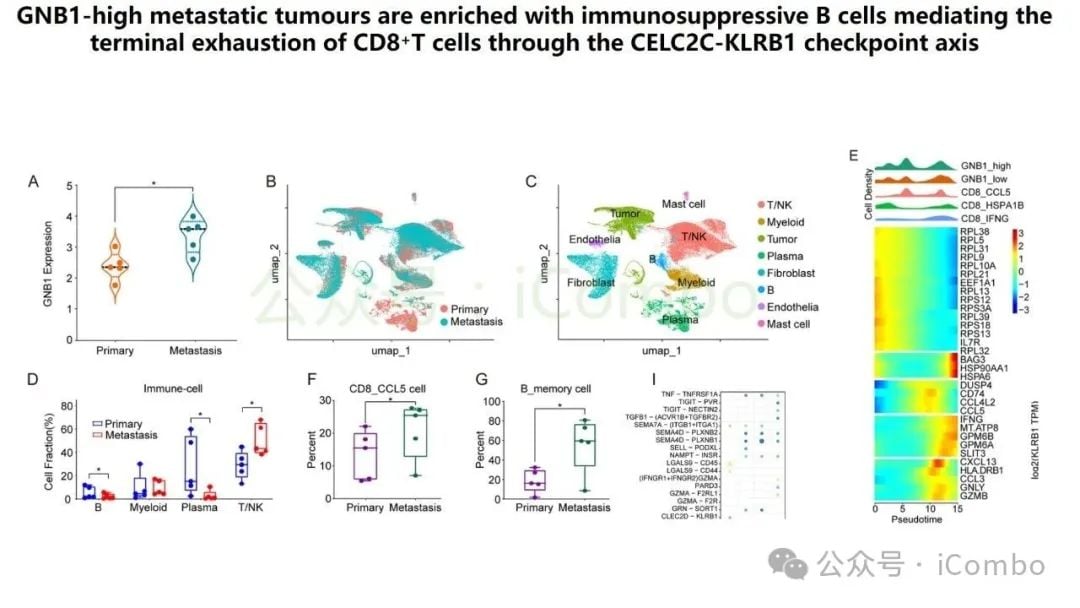
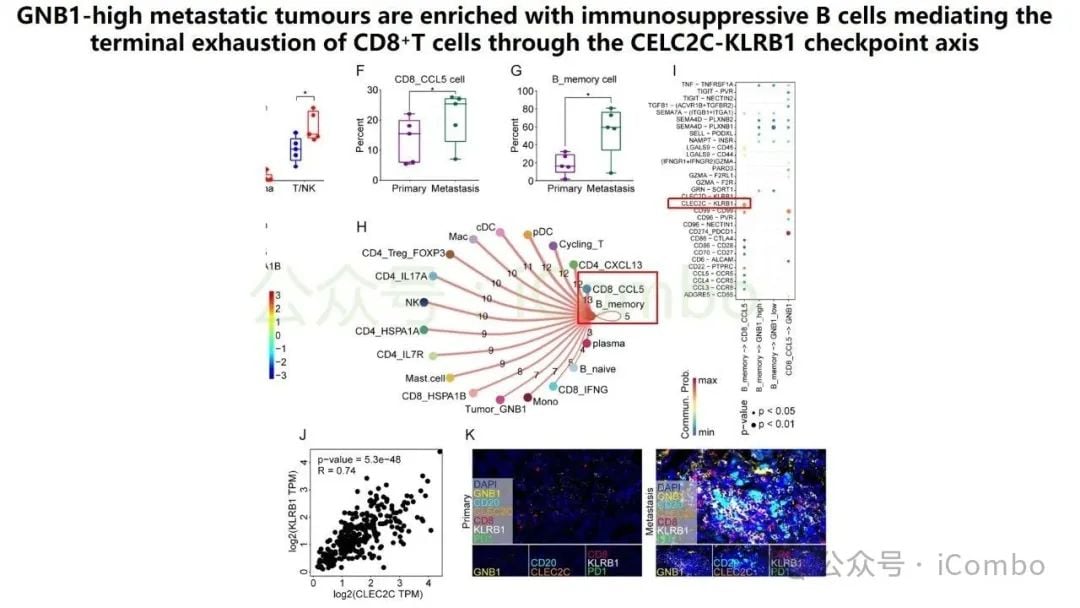
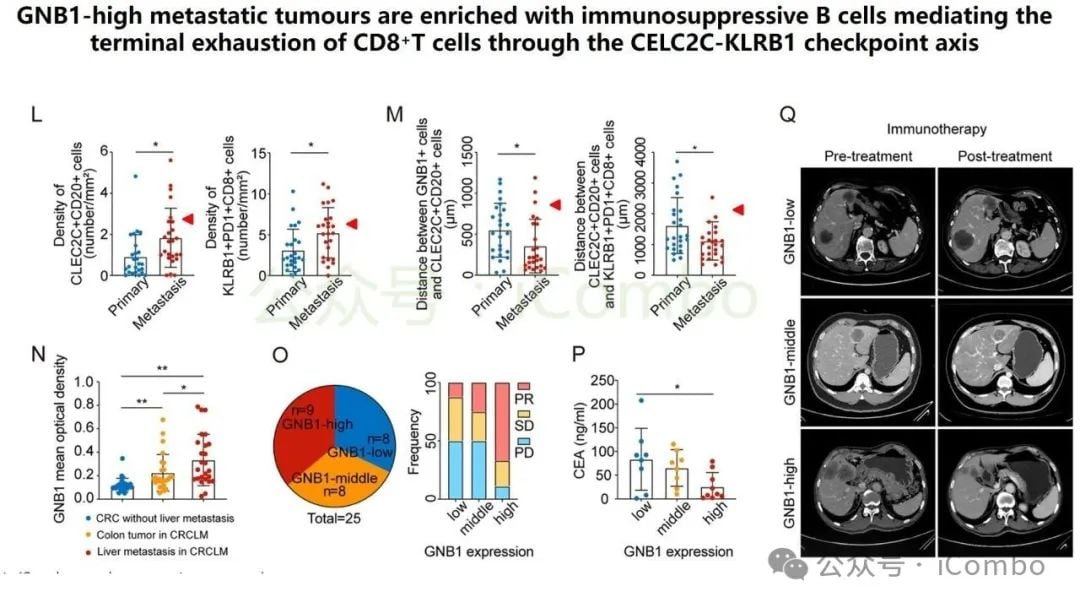
更重要的是,GNB1通过影响肿瘤微环境来促进癌症进展。它能够促进记忆B细胞与CD8+ T细胞之间一个名为“CLEC2C-KLRB1”的免疫检查点相互作用,从而形成一个免疫抑制微环境。这个微环境会削弱免疫系统的攻击能力,进而可能影响PD-1抗体等免疫治疗药物的疗效。

临床启示:GNB1作为免疫治疗新标志物的潜力
这项研究的临床分析部分带来了令人振奋的发现:GNB1高表达的患者,在接受免疫治疗(如PD-1抑制剂)时,表现出更好的治疗响应。这一结果表明,GNB1不仅是一个潜在的治疗靶点,更有望成为一个重要的生物标志物,用于预测哪些结直肠癌肝转移患者能从免疫治疗中获益最大。
通过机器学习算法和网络分析,该研究系统性地筛选了与肝转移相关的关键生物标志物、信号通路及潜在药物靶点,为制定个体化治疗策略提供了宝贵的数据支持。这些经过验证的候选靶点具有巨大的转化医学潜力,有望填补当前CRLM诊疗领域的空白,为患者带来新的希望。