引言
三阴性乳腺癌(TNBC)因其侵袭性强、治疗选项有限而成为临床上的一大挑战。近年来,靶向“溴结构域和末端外结构域”(BET)蛋白的抑制剂(BETi)为TNBC等难治性癌症带来了新的治疗希望。然而,一个严峻的问题随之而来:获得性耐药。许多患者在接受BET抑制剂治疗初期效果显著,但很快便会产生耐药,导致治疗失败。一项发表于《PNAS》的最新研究,为攻克这一难题提供了全新的思路。
BET抑制剂在三阴性乳腺癌治疗中的困境:获得性耐药
BET蛋白家族(包括BRD2, BRD3, BRD4等)是调控癌基因表达的关键“开关”。BET抑制剂,如 OTX-015 (贝拉西利),通过关闭这些开关来抑制肿瘤生长。在TNBC和急性髓系白血病(AML)等疾病中,BET抑制剂的初期疗效已被证实,但获得性耐药的出现严重限制了其长期应用。事实上,近半数评估BET抑制剂单药治疗实体瘤的临床试验,都因无法克服耐药性而宣告终止。因此,理解并逆转耐药机制,对于提升这类药物的临床价值至关重要。
揭秘耐药元凶:c-MYC的重新激活与IGF2BP2蛋白
研究发现,BET抑制剂耐药的核心在于关键癌基因 c-MYC 的“复活”。BET抑制剂原本旨在抑制c-MYC的表达,但耐药的肿瘤细胞总能找到方法重新激活它。此次研究进一步揭示了这一过程背后的关键推手——一种名为 IGF2BP2 的RNA结合蛋白。
在耐药的TNBC细胞中,IGF2BP2蛋白会增强c-MYC信使RNA(mRNA)的翻译效率,即直接“加速”c-MYC蛋白的生产。这意味着,即便药物从源头上减少了c-MYC的“设计图纸”(mRNA转录),IGF2BP2也能让工厂(核糖体)更高效地生产出最终的“产品”(c-MYC蛋白),从而使癌细胞逃避药物的打击。
破局关键:环状RNA(BISC)精准靶向,逆转耐药
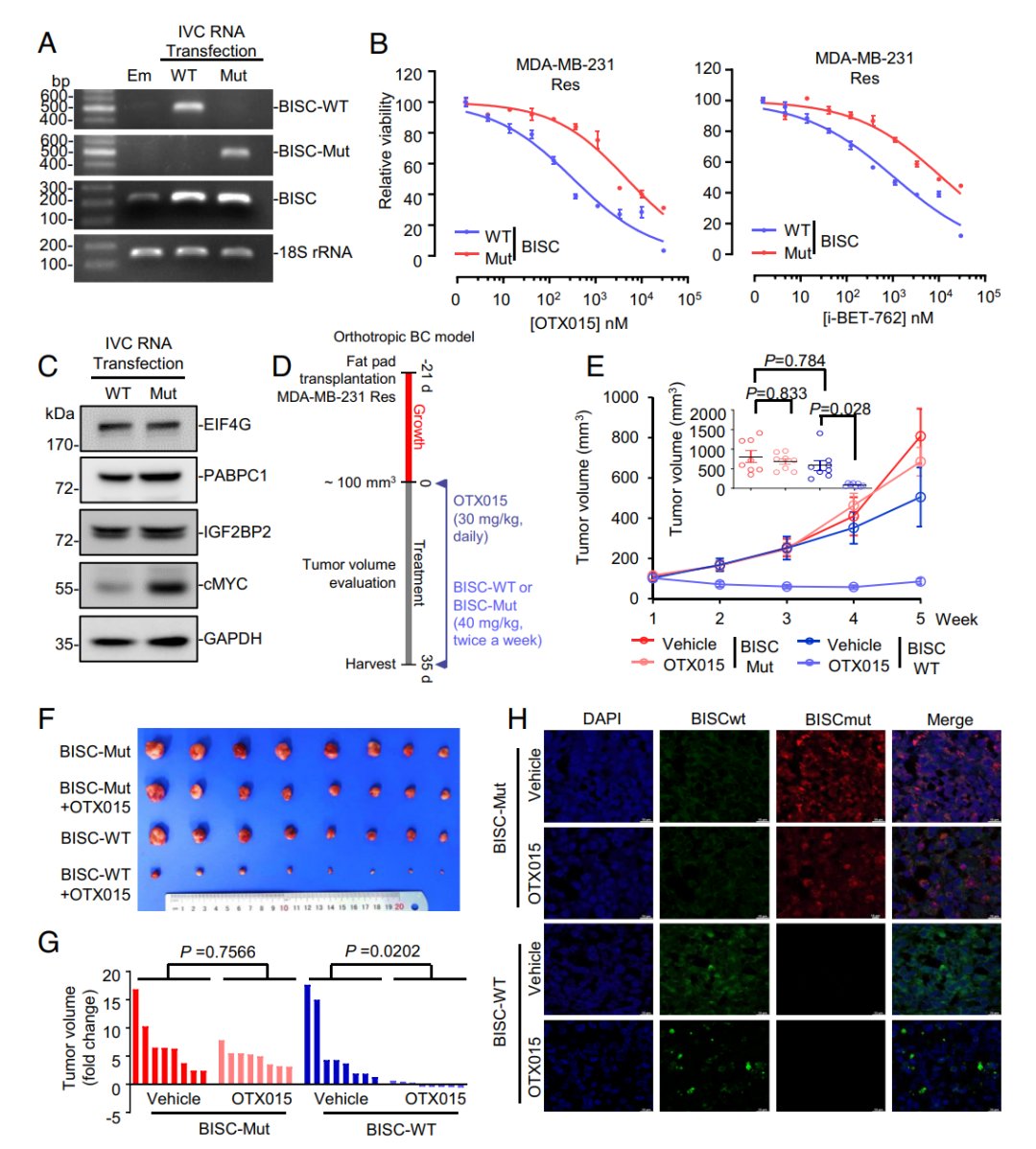
直接开发靶向IGF2BP2蛋白的小分子药物面临巨大挑战。然而,研究团队另辟蹊径,在RNA世界中找到了解决方案。他们发现了一种名为 circRNA-BISC (hsa_circ_0001573) 的环状RNA,它可以高效且特异性地与IGF2BP2蛋白结合。
BISC的作用机制非常巧妙:它像一块“磁铁”一样吸附住IGF2BP2蛋白,阻止其与c-MYC mRNA结合。如此一来,c-MYC蛋白的翻译过程便被有效抑制,耐药性也随之被逆转。作为一种治疗工具,环状RNA具有天然的优势:其环形结构使其不易被降解,稳定性远高于线性RNA,且免疫原性更低,是开发RNA疗法的理想选择。
临床前研究成果:BISC联合疗法展现强大抗癌潜力
为了验证这一策略的实际效果,研究人员在对BET抑制剂耐药的TNBC动物模型中,将人工合成的BISC与BET抑制剂 OTX-015 联合使用。结果令人振奋:联合疗法展现出显著的肿瘤消退效果,且未观察到明显的毒副作用。
这项研究不仅阐明了TNBC对BET抑制剂产生耐药的关键机制,更重要的是,它提供了一种切实可行的“RNA联合疗法”新策略。对于正在寻求BET抑制剂治疗方案,或关心其价格、购买渠道以及如何应对潜在耐药问题的三阴性乳腺癌患者而言,这项前沿突破无疑带来了新的希望,也为未来的临床治疗提供了宝贵的理论依据。





